
已知:①无水四氯化锡的熔点为-33℃、沸点为114.1℃;②四氯化锡易水解。下列说法正确的是( )
| A | B | C | D |
| | | | |
| 干燥氯气 | 收集氯气 | 探究氯气与甲烷的反应 | 证明氯气具有漂白性 |
| 选项 | 气体(杂质) | 广口瓶内的试剂 | 洗气装置 |
| A | Cl2 (HCl) | 饱和NaCl溶液 | |
| B | C2H4 (CO2) | NaOH溶液 | |
| C | C2H6 (C2H4 ) | 酸性KMnO4溶液 | |
| D | CO2 (SO2) | 饱和NaHCO3溶液 |




| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
| C | 乙酸乙酯(乙醇) | 饱和Na2CO3溶液 | 蒸馏 |
| D | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |

| 选项 | 物质(杂质) | 方法 |
| A | | 在氧气流中灼烧 |
| B | | 加热升华 |
| C | HCl气体( | 通过KI溶液 |
| D | | 加入盐酸溶解、过滤、洗涤及干燥 |
| 选项 | 目的 | 试剂 | 操作 |
| A | CO2(SO2) | 饱和碳酸氢钠溶液、浓硫酸 | 洗气 |
| B | HNO3(H2SO4) | BaCl2溶液 | 过滤 |
| C | 提取碘水中的碘 | 乙醇 | 萃取 |
| D | 检验Fe2+ | 氯水、KSCN溶液 | 向样品溶液中滴入氯水后,再滴加KSCN溶液 |
 B . 检验K2CO3中的K+
B . 检验K2CO3中的K+  C . 稀释浓硫酸
C . 稀释浓硫酸  D . 定容
D . 定容 
实验室制氨气 | 海水蒸馏制淡水 | 证明乙醇与浓硫酸共热生成乙烯 | 用CuSO4溶液净化乙炔气体 |
|
|
|
|
A | B | C | D |
| 选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
| A | Cl2(H2O) | 饱和NaCl溶液 | 洗气 |
| B | CH3CH2OH(H2O) | CaO | 蒸馏 |
| C | FeCl2(FeCl3) | Cu | 过滤 |
| D | | CCl4 | 萃取 |

 蒸发溴水获取溴单质
B .
蒸发溴水获取溴单质
B . 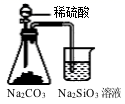 证明碳酸酸性强于硅酸
C .
证明碳酸酸性强于硅酸
C .  比较NaHCO3和Na2CO3的热稳定性
D .
比较NaHCO3和Na2CO3的热稳定性
D .  除去氯气中的HCl杂质
除去氯气中的HCl杂质
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 蒸馏 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | FeCl2(FeCl3)溶液 | 过量铜粉 | 过滤 |
| D | 乙烯(SO2) | 酸性高锰酸钾溶液 | 洗气 |
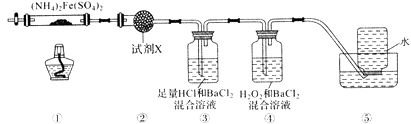
实验室合成SOCl2的原理之一为SO2+Cl2+SCl22SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
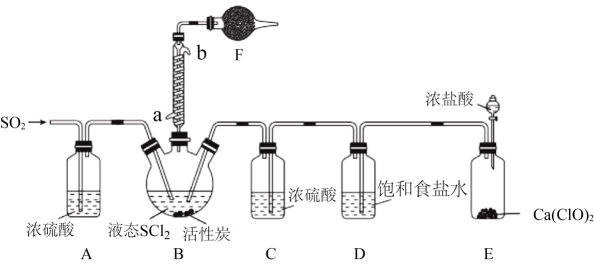
②装置A、C除干燥气体外,另一作用可能是;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:。
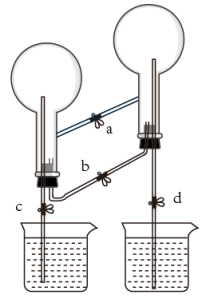
a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水


①各仪器接口连接顺序为(气流自左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 。
③装置A用冰水冷却的目的是。

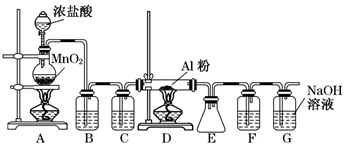
①装置I需控制温度约为70℃,适宜的加热方式是 ,温度不宜过高,其目的是。
②装置Ⅱ的名称是。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2 , 然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHCl3和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 。
步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是;步骤Ⅱ中证明已洗涤干净的依据是;步骤Ⅲ中加入少量无水CaCl2的目的是 。
 与
与  ④CH4与CH3CH2CH3⑤CH3CH3与
④CH4与CH3CH2CH3⑤CH3CH3与  。
。 其中互为同位素的是(填序号,下同),互为同系物的是。
a.2CO2+6H2 CH3CH2OH+3H2O
b.CO2+CH4 CH3COOH
以上反应中原子利用率较高的是(填字母。)
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
为确保反应③只生成NaNO2 , 理论上应控制NO与O2的物质的量之比为;此时反应④的离子方程式为。若n(NO) :n(O2)=3:1,且NaOH溶液足量,则所得溶液1中NaNO3与NaNO2的物质的量之比为。