
查阅资料:
| 物理性质 | 物理性质 | |
| 金属锂(Li) | 熔点180C,沸点1340C | 与氨气反应: 2Li+2NH3=2LiNH2+H2↑ |
| 氮化锂 (Li3N) | 红色晶状固体,能吸附H2 | ①易水解:Li3N+3H2O=3LiOH+NH3↑ ②高温时能腐蚀镍、铜、石英等 |
回答下列问题:

二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
反应III:2CO2(g)+ 6H2(g) CH3OCH3(g)+3H2O(g) ∆H3
a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
CH3OCH3(g) CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
| 反应时间t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
| 气体总压p总/kPa | 10.0 | 13.6 | 15.8 | 17.7 | 18.9 | 20.0 |
由表中数据计算:反应达平衡时,二甲醚的分解率为,该温度下的平衡常数Kp= (kPa)2. (Kp为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)
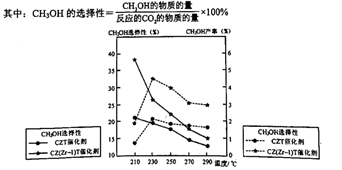
①温度高于230℃,CH3OH产率随温度升高而下降的原因是。
②在上述条件下合成甲醇的工业条件是。
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
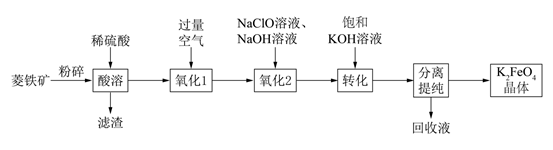
已知:①K2FeO4可溶于水、微溶于浓KOH溶液;
②FeO 在强碱性溶液中稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
回答下列问题:
a.H2SO4溶液 b.KOH浓溶液 c.Fe2(SO4)3溶液
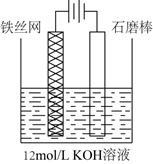
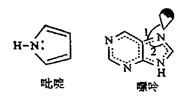
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
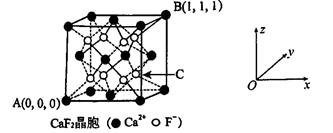
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(,, )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。

已知:芳纶(PPTA)的结构简式为: 
回回答下列问题:。