
下列说法正确的的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将NaOH溶液逐滴滴加到AlCl3溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
| B | NaHCO3溶液与NaAlO₂溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
| C | 向盛有Na2SiO3 , 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
| D | | 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |




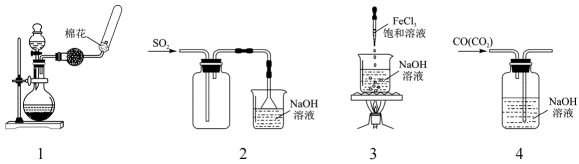
Ⅰ.用已准确称量的 固体配制一定体积的
标准溶液;
Ⅱ.取 L上述溶液,加入过量
,加
酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用 ![]() 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液
L。
已知:
和
溶液颜色均为无色

①若选择试剂A和D,则甲中发生反应的化学方程式为。
②若只用一种试剂制取氨气,则该试剂的最佳选择为 (选填试剂标号),此时,甲中空白处所需装置应为 (选填下列标号)。
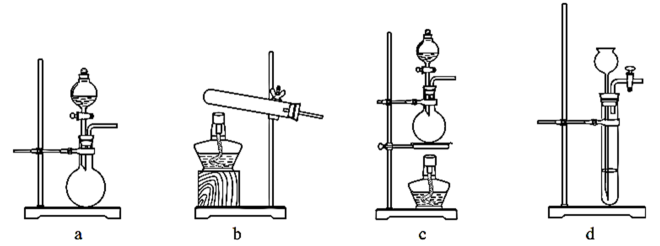
③实验结束后从戊中取出少量液体于试管中,滴入紫色石蕊试液,当观察到现象时,说明已制得硝酸。若没有观察到此现象,可能的原因是。
①实验任务:通过设计实验探究Fe(NO3)3溶液溶解银的原因。
②查阅资料:在不同条件下的还原产物较复杂,有时难以观察到气体产生。
③提出猜想:猜想a:Fe3+具有氧化性,能够氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性条件下能氧化Ag。
④设计实验、验证猜想
Ⅰ. 甲同学从上述实验的生成物中检测出Fe2+ , 验证了猜想a成立。请写出Fe3+氧化Ag的离子方程式。
Ⅱ. 乙同学设计实验验证猜想 , 请帮他完成下表中内容
实验步骤(不要求写具体操作过程) | 预期现象和结论 |
① ② | 若银镜消失,猜想b成立; 若银镜不消失,猜想b不成立。 |
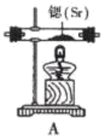


已知:实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气。回答下列问题:
气流从左至右,选择装置并排序为 (用字母表示)。

试管II、III、IV盛装的试剂分别是(填标号),装置Ⅵ的作用是。
a.连苯三酚碱性溶液 b.浓硫酸 c.醋酸二氨合亚铜溶液
测定产品纯度:称取9.0g方案II中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用 的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)。从烧杯中量取
的吸收液,用
标准溶液滴定过剩的HCl,到终点时消耗
溶液(图中夹持装置略)

a.石蕊试液 b.甲基橙 c.酚酞试液
a.锥形瓶洗涤干净后未干燥,直接装入待测液
b.滴定时未用 标准溶液润洗滴定管
c.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
d.读数时,滴定前平视,滴定后俯视

①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2 , 但装置 I 比装置Ⅱ更好,理由;检验氯气所用的试纸是。

①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是,制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-。
②装置VII中仪器 X 的名称是 ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ;装置VII末端接抽气水泵的目的是。
步骤1:称取1.9640g Ka[Feb(C2O4)c]·xH2O晶体,配制成250.00mL溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,加入1mol/LH2SO45.0mL,加热到70~85℃,用0.01000mol/LKMnO4溶液滴定至终点(5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O),消耗KMnO4溶液48.00mL。
步骤3:向反应后的溶液中加入一定量锌粉。加热至黄色恰好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤4:继续用0.01000mol/LKMnO4溶液滴定步骤3所得溶液至终点,消耗KMnO4溶液8.00mL。
已知:MnCO3+2NH4Cl MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
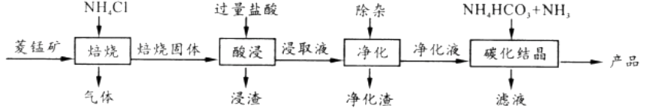
焙烧时适宜温度为;800℃以上锰的浸取率偏低,可能原因是。
②加氨水调pH,生成沉淀主要是;
③加入NH4F,除去Ca2+、Mg2+。
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4 , 发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I- , 滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是。
②假设杂质不参与反应,则产品纯度为。
①;②.
准确称取 产品于锥形瓶中,加入30mL蒸馏水和
,用
标准溶液滴定至终点
重复上述操作两次。
③滴定终点观察到的现象为 。
④根据表1数据,计算产品中 的质量分数 。(保留四位有效数字)
表 标准溶液滴定数据

I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。

回答下列问题:
①B装置中反应的离子方程式为。
②C装置冰水混合物的作用是。
取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择。
a.甲基橙
b.配酞
c.甲基橙或酚酞
②该谷物样品中氮的百分含量为。(保留2位小数)
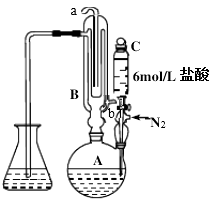
实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
A.酸式无色滴定管
B.酸式棕色滴定管
C.碱式无色滴定管
D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为,滴定终点的现象是。
当 mL时,溶液中所有离子的浓度存在的关系是。
已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于 mol/L时,可认为已完全沉淀。
A.滴定终点读数时,俯视滴定管刻度,其他操作符合题意。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
|
滴定次数 |
待测液体积 (mL) |
标准KMnO4溶液体积(mL) |
|
|
滴定前读数 |
滴定后读数 |
||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
3.00 |
23.00 |
|
第三次 |
25.00 |
4.00 |
24.10 |
①滴定时发生的离子反应方程式,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是。
②该草酸溶液的物质的量浓度为。
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
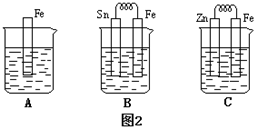
①图2 B中的Sn为极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)。
②图2 C中被腐蚀的金属是。比较A,B,C中纯铁被腐蚀的速率由快到慢的顺序是。

①氢氧燃料电池的电极反应是:。电池工作一段时间后硫酸溶液的浓度(填“增大”“减小”或“不变”)。
|
滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
|
滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果。
②锥形瓶未用待装溶液润洗,使滴定结果。
③装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果。
④滴定前平视凹液面,滴定终了俯视凹液面,使滴定结果。
取某无色饮料20.00 mL加入稀硫酸充分煮沸,冷却,加入过量氢氧化钠溶液并稀释至 100.00 mL。取 10.00 mL 稀释液,加入 30.00 mL 0.01500 mol ·L-1I2 标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200 mol • L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液25.00 mL。
已知:①I2在碱性条件下能与葡萄糖发生如下反应:
C6H12O6+I2+3NaOH = C6H11O7Na+2NaI+2H2O
② Na2S2O3 与I2 能发生如下反应:I2+2Na2S2O3 = 2NaI+Na2S4O6
实验I.草酸根含量的测定
称取0.9820g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358K,用0.2000mol/L KMnO4溶液滴定,滴定过程中草酸转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4 溶液12.00 mL。
实验II. 铁含量的测定
将上述滴定过的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液作指示剂,用0.2500mol/LNa2S2O3标准溶液滴定至终点。共消耗Na2S2O3溶液8.00mL.(已知: 实验II中涉及的部分离子方程式为I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题:

滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。
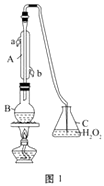


仪器A的名称是,水通入A的进口为。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。

请写出pH≤2.0时ClO2-与I-反应的离子方程式:。
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。