试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③ | ④,有刺激性气体产生 |
⑤静置, | ⑥ |
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH= kJ·mol−1。
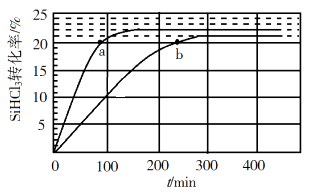
①343 K时反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有、。
③比较a、b处反应速率大小:vavb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆= −
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
=(保留1位小数)。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知: ![]()
回答下列问题: