


①三颈烧瓶中加入香菇样品和
水;锥形瓶中加入
水、
淀粉溶液,并预加
的碘标准溶液,搅拌。
②以流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液。
③做空白实验,消耗了碘标准溶液。
④用适量替代香菇样品,重复上述步骤,测得
的平均回收率为95%。
已知: ,
回答下列问题:

Sn与Si同族,25℃时相关的溶度积见表。
化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+ , 且无气体生成,则生成的硝酸盐是,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2 , 焙烧时,与NaOH反应的化学方程式为。
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于mol•L-1。
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+ , 再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO被还原为I— , 终点时消耗KIO3溶液20.00mL。
①终点时的现象为,产生I2的离子反应方程式为。
②产品中Sn的质量分数为%。
步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I- , 冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数。

已知:①制备原理: , (保持70℃左右)
②有关物质的性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/ | |
乙醇 | 46 | -117 | 78.5 | 与水互溶 | 0.789 |
三氯乙醛 | 147.5 | -57.5 | 97.8 | 溶于水、乙醇 | 1.51 |
请回答:

①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤标准溶液润洗滴定管→→到达滴定终点,停止滴定,记录读数。
a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作 , 排出滴定管尖嘴部分的气泡
, 排出滴定管尖嘴部分的气泡
g.如图操作 , 排出滴定管尖嘴部分的气泡
, 排出滴定管尖嘴部分的气泡
②产品的纯度是%(计算结果保留2位小数)
![]()
“操作”是指;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的(填写仪器名称)。

a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤I:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤II:向步骤I所得的溶液中加入适量稀H2SO4溶液,用0.0020mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①步骤I加入过量铜粉的目的是。
②步骤II滴加KMnO4溶液时发生反应的离子方程式为。
③用KMnO4标准溶液滴定至终点的标志是。。
④黑木耳中铁的含量为mg/100g(即每100g黑木耳中含铁元素的质量)。

实验过程:将净化的VOCl2溶液缓慢加入到足量NH4HCO3溶液,有气泡产生,析出紫红色晶体。待反应结束后,在有CO2保护气的环境中,将混合液静置一段时间,抽滤,所得晶体,洗涤2次,得到粗产品。回答下面问题:


仪器b的名称是,仪器c的作用是。
①滴定终点时的现象为。
②粗产品中钒的质量分数为。

资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 有关性质 |
PCl₃ | -93.6 | 76.1 | 遇水剧烈水解,易与O₂反应 |
POCl₃ | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl₃ |
SOCl₂ | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
①滴定选用的指示剂是(填标号)。
a.酚酞 b.淀粉 c.NH₄Fe(SO4)2 d.甲基橙
②产品中POCl₃的质量分数为%(保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10⁻10 , Ksp(AgSCN)=2×10⁻¹²,若无硝基苯覆盖沉淀表面,测定产品中POCl₃的质量分数将(填“偏大”“偏小”或“无影响”)。
步骤①的主要反应为FeO·Cr2O3 + Na2CO3 +NaNO3Na2CrO4+ Fe2O3 + CO2+NaNO2(未配平) ,氧化产物为,配平后FeO· Cr2O3与NaNO3的化学计量数之比为。

I.火法工艺:
在空气中煅烧辉钼矿可得到MoO3 , 然后经过一系列处理制得钼酸铵。

已知:①滤液中的主要成分是 、
;②
易溶于有机溶剂。
③25 ℃时相关物质的Ksp如下表所示:
物质 | Cu(OH)2 | Fe(OH)3 |
Ksp | 1×10-19.6 | 1×10-38.6 |
滤渣的主要成分是Cu(OH)2和Fe(OH)3 , 则加入NaClO碱性溶液反应后得到的浸取液的pH最小值为 。( 当溶液中某离子浓度1×10-5mol·L-1时,可认为该离子沉淀完全。)
查阅资料: PdCl2溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
回答下列问题:

①实验结束后,打开开关K通氮气,其目的是。
②试剂X的作用为。
③若气体产物中含有CO,则观察到的现象为, 其中反应的化学方程式为。
①还原后固体混合物中单质Cu的质量分数为%。
②若CuI吸附部分 ,会导致所测Cu单质的质量分数 (填“偏大”、“偏小”或“无影响”)。

①滴定终点的现象为:。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量(填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为%。
称取一定质量草酸钾固体,加入蒸馏水,加热。溶解。时,边搅拌边向草酸钾溶液中加入过量
溶液。将上述溶液置于冰水中冷却至绿色晶体析出。用布氏漏斗过滤、乙醇洗涤、干燥得三水合草酸合铁酸钾晶体。整个过程需避光。
用无水配制所需
溶液,下列仪器中不需要的是(填仪器名称)。
取少量晶体配成溶液,用标准酸性高锰酸钾溶液进行第一次滴定,达终点时消耗
标准液,向滴定后的溶液中加入过量锌粒将
还原为
。过滤,用该高锰酸钾溶液进行第二次滴定,终点时消耗
标准液(杂质不反应)。
第二次滴定时的离子反应方程式为。
A.样品中含有草酸钾杂质
B.第一次滴定前尖嘴有气泡,滴定后气泡消失
C.第二次滴定终点读数时仰视
D.第二次滴定终点时颜色为深紫红色
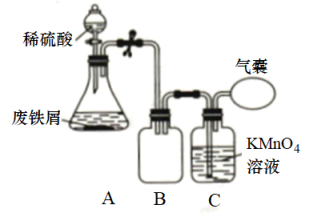
Ⅰ.碱煮水洗:将6.0g废铁屑置于锥形瓶中,加入20mL30%的溶液,加热煮沸一段时间,倾去
溶液,水洗至中性;
Ⅱ.的制备:向处理过的铁屑中加入稀
反应,结束后趁热过滤;
Ⅲ.硫酸亚铁铵晶体的制备:向滤液中迅速加入一定体积的饱和溶液,经蒸发皿加热至出现晶膜时停止加热,冷却结晶硫酸亚铁铵晶体,再过滤、洗涤、干燥得到产品。
回答下列问题:
准确称量20.00g硫酸亚铁铵晶体样品,配制成100mL溶液。取所配溶液25.00mL于锥形瓶中,加稀酸化,用0.1000
标准溶液滴定至终点,重复两次,平均消耗
标准溶液18.00mL。
①判断达到滴定终点的标志是。
②样品中的质量分数为。
已知的
。
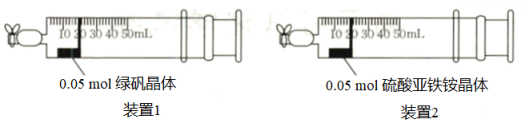
向两支注射器中分别放入0.05mol的绿矾晶体和硫酸亚铁铵晶体,向右侧拉动注射器活塞,各吸入20mL空气后关闭注射器针头处的夹子(密封性良好),放置一段时间后,取出两种晶体,用无氧蒸馏水溶解配成等体积的溶液,向溶液中各滴加几滴KSCN溶液。
①获得无氧蒸馏水的方法为。
②若硫酸亚铁铵晶体的抗氧化能力强,则放置一段时间后,活塞向左移动的距离较长的是(填“装置1”或“装置2”)。

i.Ge和GeO2均不溶于盐酸;GeCl4易潮解,沸点为88℃。
ii.(未配平);
。
回答下列问题:
称取m g制得的GeO2样品,在加热条件下溶解,用NaH2PO2将其还原为Ge2+ , 用c mol·L-1 KIO3标准溶液滴定,消耗KIO3标准溶液的体积为V mL,需选用的滴定指示剂为,样品纯度为%。(实验条件下,NaH2PO2未被KIO3氧化)
将KClO3和KOH置于铁坩埚中加热熔融,分多次将MnO2粉末加入,强热5分钟。充分反应后冷却,将固体捣碎,加水溶解,微热,趁热减压过滤得到K2MnO4溶液。
反应的化学方程式为。
实验原理:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3
实验装置如图所示,将K2MnO4溶液转移到三颈烧瓶中,关闭旋塞2、5,打开旋塞1、3、4,趁热往K2MnO4溶液中通入CO2发生反应,没有反应的CO2被收集到气囊a中。

待气囊a收集到较多气体时,关闭旋塞1和旋塞,打开旋塞,轻轻挤压气囊a,将气体压入K2MnO4溶液中继续反应。未反应的CO2又被收集在气囊b中,如此反复直至K2MnO4完全歧化,经过一系列操作得到KMnO4晶体。整个过程中温度不宜过高的原因是。
准确称取2.00gKMnO4产品溶于水,配成100.00mL溶液。用移液管取25.00mL0.2mol·L-1的H2C2O4溶液于锥形瓶中,并加入2mL稀硫酸。用上述KMnO4溶液滴定H2C2O4溶液,重复操作3次,消耗KMnO4溶液的体积平均为20.00mL。
滴定终点的现象是,计算可得产品中KMnO4的纯度是,下列情况会导致KMnO4纯度测定值偏小的是(填标号)。
A.产品含少量K2MnO4 B.酸式滴定管滴定后有气泡
C.酸式滴定管没有润洗 D.滴定接近终点时用少量蒸馏水冲洗锥形瓶内壁
V2O5 VOCl2溶液
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
已知:①氧化性:V2O5 > Cl2;②VO2+能被O2氧化。

①为了排尽装置中的空气,防止VO2+被氧化,上述装置依次连接的合理顺序为c→(按气流方向,用小写字母表示)。
②连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为。
称量ag产品于锥形瓶中,用稀硫酸溶解后得到VO2+的溶液,加入0.02mol·L-1 KMnO4溶液至稍过量,加入某还原剂除去过量KMnO4溶液,最后用cmol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(VO+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为(以VO2+计,式量为67)。若(NH4)2Fe(SO4)2标准溶液部分变质,则测定结果(填“偏高”、“偏低”或“无影响”)。

有关信息如下表:
化学式 | Sn | SnCl2 | SnCl4 |
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易水解生成SnO2 |
①实际制备的产品往往含有SnCl2 , 甲同学设计实验测定Sn2+的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,用amol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是。
②乙同学设计实验测定产品中Cl-的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2mL。硝酸银溶液最好盛放在(填序号)滴定管中。
A.无色酸式滴定管B.棕色酸式滴定管C.无色碱式滴定管D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是(填序号)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 白 | 砖红 |
Ksp | 1.77×10-10 | 5.4×10-14 | 2.7×10-16 | 1.12×10-12 |
A.NaCl溶液B.NaBr溶液C.NaCN溶液D.Na2CrO4溶液
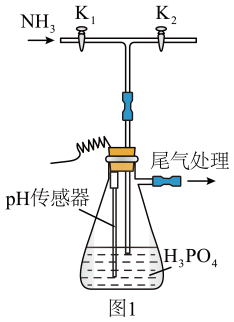
实验过程中,当出现倒吸现象时,(填写实验操作,下同),当上述现象消失后,,继续通入氨气。

![]()
已知:ⅰ.时,
易被氧气氧化;
ⅱ.几种物质的溶解度如表:
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
第一次加稀硫酸调溶液至1~2的目的是。

下列实验操作的正确顺序为(填序号)。
①点燃酒精灯,小火加热 ②停止通入氮气,关闭、
③打开、
④熄灭酒精灯,冷却至室温
⑤缓缓通入氮气 ⑥称重A
重复上述操作步骤,直至A恒重,记为。假设此过程中
不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目
(列式表示)。

已知:①浸出液中含有的金属离子主要有Co2+、Fe2+、Fe3+、Al3+。
②氧化性H2O2>Co3+>>Fe3+。
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
沉淀物 | Fe(OH)3 | Co(OH)3 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.7 | \ | 7.6 | 4.0 |
完全沉淀 | 3.7 | 1.1 | 9.2 | 5.2 |

为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

将下列实验操作步骤正确排序→→→→c→e(填字母);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2
e.称量A
f.冷却到室温
该小组用如图所示装置进行实验(夹持仪器略)。

在实验过程中,观察到A中固体变红棕色,B中的现象:;C中试纸的颜色变化是。
将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1 , 在100℃时,M的化学式为。


HCOOH+
NaOH+
_=
Na2S2O4+
CO2+
_;
实验过程中需控制SO2 , 确保NaOH过量的原因是;充分反应后通过分液漏斗滴加一定量乙醇的目的是。

I.取一定量化学计量比的Ce(NO3)3·6H2O和NaOH分别溶解在5mL和35mL的去离子水中,分别磁力搅拌30min后,再将两种液体混合,继续磁力搅拌30min,形成白色絮状沉淀[Ce(OH)3]。将混合溶液加热(并通入O2),在一定温度下反应一段时间。通过离心方法将Ce(OH)4沉淀分离出来。
II.用水和无水乙醇分别洗涤Ce(OH)4沉淀3次。
III.将洗涤后的样品转入干燥炉中,在60℃下干燥24h,得到淡黄色粉末CeO2。
盛放NaOH溶液的仪器名称为,无水乙醇的作用是。
称取mg样品置于锥形瓶中,加入50mL水及20mL浓硫酸,分批加入H2O2溶液,每次5mL,摇匀,低温加热,直至样品完全溶解。加热除尽锥形瓶中的H2O2 , 冷却后稀释至250mL,加入5mL10g·L-1AgNO3溶液催化,再加入过量的过硫酸铵[(NH4)2S2O8]溶液,低温加热,将Ce3+氧化成Ce4+ , 当锥形瓶中无气泡冒出,再煮沸2min。待冷却后,加入5滴邻二氮菲-亚铁指示液,用(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗cmol·L-1的(NH4)2Fe(SO4)2标准溶液VmL。已知邻二氮菲与Fe2+可形成红色配合物,这种离子可示表为[Fe(phen)3]2+。
实验中分批加入H2O2溶液时,采取低温加热的原因是。
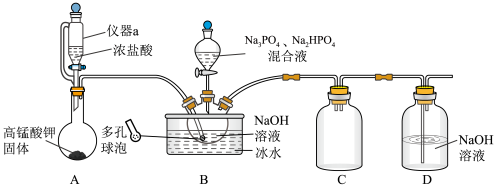
问答下列问题:
①上述装置存在一处缺陷,会使”消洗灵”(Na10P3O13Cl·5H2O)的产率降低,改进的方法是。
②“系列操作”包括、、过滤、洗涤、低温干燥。
I.取4.00g产品试样溶于蒸馏水中配成200mL溶液;
II.量取20. 00 mL待测液于锥形瓶中,加入10 mL2 mol·L-1硫酸溶液、25 mL0.1 mol·L-1KI溶液(过量) ,暗处静置5min;
III.滴加2~3滴淀粉溶液,用0. 0500 mol ·L-1Na2S2O3标准溶液滴定,发生反应: I2+2 =2I-+
。平行滴定三次,平均消耗20. 00 mL标准溶液。
①Na2S2O3标准液应放在 ( 填“碱”或“酸”)式滴定管中。
②则产品的纯度为(保留三位有效数字)。

已知:TeO2具有强还原性,且TeO2、Cu2TeO4均难溶于水;高碲酸钠的化学式为Na2TeO4。
回答下列问题:

称取样品,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用
的盐酸标准溶液吸收,蒸氨结束后取下接收瓶。取吸收液用
标准溶液滴定过剩的HCl,达到终点时消耗
溶液。

仪器a是(填名称)。
部分指示剂变色的pH范围如下表:
指示剂名称 | 变色的pH范围 | 酸色 | 中性色 | 碱色 |
甲基橙 | 3.1—4.4 | 红 | 橙 | 黄 |
甲基红 | 4.4—6.2 | 红 | 橙 | 黄 |
溴百里酚蓝 | 6.0—7.6 | 黄 | 绿 | 蓝 |
酚酞 | 8.2—10.0 | 无 | 浅红 | 红 |
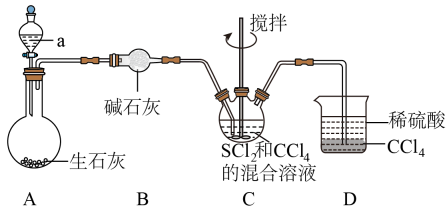
高温下用还原
可制得金属铼,装置如下图所示:

[已知:受热分解生成
]
①装置B中盛放的试剂为(填名称)。
②判断A中已经反应完全的方法是。
③玻璃管内发生反应的化学方程式为。

已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100gH2O)如表:
温度/℃ | 0 | 20 | 30 | 40 | 100 |
NH4Fe(SO4)2 | 70.6 | 75.4 | 78.3 | 81.0 | 102.1 |
NH4Al(SO4)2 | 2.1 | 5.0 | 7.7 | 10.9 | 26.7 |

部分物质的沸点如表所示:
物质 | |||
沸点/℃ | 12.5 | 180 |
回答下列问题:
已知:S4N4+6OH-+3H2OS2O
+2SO
+4NH3↑
回答下列问题:
i.蒸氨:取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出的NH3通入含有V1mLc1mol•L-1H2SO4标准溶液的锥形瓶中。
ii.滴定:用c2mol•L-1溶液滴定剩余的H2SO4 , 消耗V2mLNaOH溶液。
①滴定管的正确操作顺序:检漏→蒸馏水洗涤→(填标号)→开始滴定。
a.装入滴定液至“0”刻度以上
b.调整滴定液液面至“0”刻度
c.排除气泡
d.用滴定液润洗2至3次
e.记录起始读数
②滴定时选用的指示剂为;在接近终点时,放液使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,,继续摇动锥形瓶,观察溶液颜色变化。
③S4N4的纯度表达式为;若所用NaOH溶液实际浓度偏低,测定结果(填“偏高”“偏低”或“无影响”)。

①装置C的名称,装置D的作用是;装置E的作用是。
②写出装置A中发生反应的化学方程式。
③实验时,将装置C浸入(填“热水”或“冰水”)中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。关闭分液漏斗的活塞,打开活塞K,通过臭氧发生器向装置C中通入含有臭氧的氧气。
①产品中N2O4与KMnO4发生反应的离子方程式为。
②判断滴定终点的方法是。
③产品中N2O4的质量分数为。
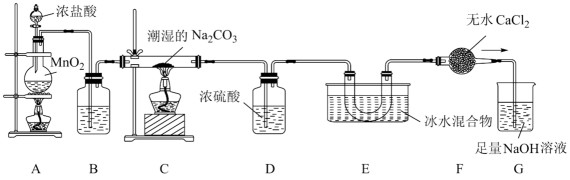
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6℃;沸点2.0℃。
温度/℃ | 纯碱含水量/% | Cl2O收率/% |
0~10 | 5.44 | 67.85 |
0~10 | 7.88 | 89.26 |
10~20 | 8.00 | 64.24 |
30~40 | 10.25 | 52.63 |
30~40 | 12.50 | 30.38 |

已知:①
物质 | 苯 | 乙醚 |
易溶 | 可溶 | |
难溶 | 可溶 | |
LiH | 微溶 | |
LiCl | 难溶 |
②LiH、在潮湿的空气中都会发生剧烈水解。
③乙醚易燃,一般不与金属单质反应,沸点34.5℃。
请回答:
a.将操作B剩余液体置于蒸馏烧瓶中
b.将操作B后剩余液体倒入漏斗中过滤
c.用余热蒸干苯
d.开冷凝水、加热
e.将固体放入苯液中进行搅拌、浸泡和反复清洗、过滤
f.转移固体至烧瓶中真空脱苯
g.转移固体至表面皿中低温加热干燥脱

注:量气管B由碱式滴定管改装;25℃,常压下气体摩尔体积约为24.5L/mol。