实验1:实验测得0.0100 mol∙L−1 Na2C2O4溶液的pH为8.6。
实验2:向溶液中滴加等体积、0.0100 mol∙L−1 HCl溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积、0.0200 mol∙L−1 CaCl2溶液,出现白色沉淀。
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色。
已知室温下Ksp(CaC2O4)=2.5×10−9 , 下列说法错误的是

已知: I.20℃时LiOH的溶解度为12.8g。
II.Li2CO3在不同温度下的溶解度:0℃ 1.54 g,20℃ 1.33 g,80℃ 0.85 g。
①装有盐酸的仪器的名称为。
②装置B中盛放的试剂为,其作用是。
③装置C中除了生成LiHCO3 , 还可能生成的杂质为(填化学式)。
④装置C中的反应需在常温下进行,温度越高锂精矿转化率越小的原因可能是。保持温度、反应时间、反应物和溶剂的量不变,实验中提高锂精矿转化率的操作有。
⑤热解过滤获得的Li2CO3表面有少量Li2C2O4 , 不进行洗涤也不会影响最终Li2CO3产品的纯度,其原因是。

已知:TeO2具有强还原性,且TeO2、Cu2TeO4均难溶于水;高碲酸钠的化学式为Na2TeO4。
回答下列问题:

已知:①常温常压下,H2和CH4的燃烧热(ΔH)分别为- 285.5kJ ·mol-1和-890.0 kJ ·mol-1;
②H2O(l)=H2O(g) ΔH2=+44.0 kJ ·mol-1。
ΔH1= kJ ·mol-1。


①压强p1、p2、p3由大到小的顺序是。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因:。
恒压条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度关系如图。

350℃时,A点的平衡常数K= (填计算结果)。 为提高CO2的转化率,除改变温度外,还可采取的措施为。

①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是。
②的立体构型为,中心原子的杂化类型是。

晶体中
;已知原子A、B的分数坐标分别为
和
, 则原子C的坐标为,设阿伏加德罗常数的值为
,
的密度为g·cm
。
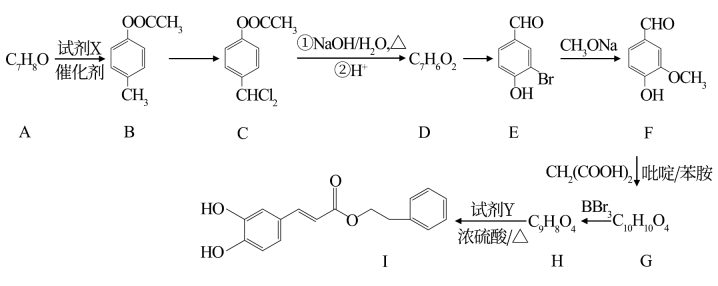
已知:①同一碳原子上连两个羟基不稳定,发生反应:R- CH(OH)2→R-CHO+ H2O;
②R- CHO+R1-CH2COOHR –CH=CH- R1+ H2O+CO2↑;
③![]() 。
。
①苯环上只有两个侧链
②只有一种官能团且能与NaHCO3溶液反应放出气体
其中核磁共振氢谱显示有3组峰,且峰面积之比为2:2:1的同分异构体的一种结构简式为。