

乙酸 | 正丁醇 | 乙酸正丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度(g/cm3) | 1.1 | 0.80 | 0.88 |
下列说法错误的是
a. b.
c. d.

 )可与氨反应转化为吡咯(
)可与氨反应转化为吡咯( )。二者均存在与苯类似的大
)。二者均存在与苯类似的大 的大
的大
①据此推断该晶胞中氯原子数目为。的摩尔质量为
, 晶胞密度为
, 则阿伏加德罗常数的值
为(列出计算表达式,后同)。
②图中A、B两原子的核间距为nm。
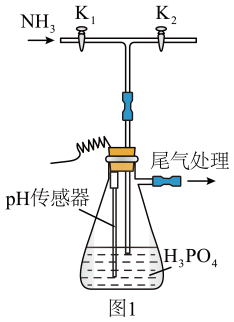
实验过程中,当出现倒吸现象时,(填写实验操作,下同),当上述现象消失后,,继续通入氨气。

![]()
已知:ⅰ.时,
易被氧气氧化;
ⅱ.几种物质的溶解度如表:
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
第一次加稀硫酸调溶液至1~2的目的是。

下列实验操作的正确顺序为(填序号)。
①点燃酒精灯,小火加热 ②停止通入氮气,关闭、
③打开、
④熄灭酒精灯,冷却至室温
⑤缓缓通入氮气 ⑥称重A
重复上述操作步骤,直至A恒重,记为。假设此过程中
不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目
(列式表示)。

已知:钪与铝类似,其氢氧化物具有两性;是钪元素的萃取剂,萃取发生的反应为
。
 )是一种重要的化工原料,以
)是一种重要的化工原料,以 为原料通过脱水、腈化合成丙烯腈的主要反应如下:
为原料通过脱水、腈化合成丙烯腈的主要反应如下:
 的名称为。
的名称为。

①随着温度的升高,平衡的物质的量分数先增大后减小的原因是。
②a点对应反应的压强平衡常数(保留两位有效数字)。
③在实际生产中,充入一定量(
不参与反应)可以提高丙烯腈的平衡产率,原因是。
反应ⅰ:

反应ⅱ:
恒温恒容条件下,向密闭容器中加入一定量
和
, 图甲为该体系中B、M、C浓度随时间变化的曲线,图乙为反应ⅰ和ⅱ的
曲线(
, k为速率常数,
为反应活化能,R、C为常数)。

①在时刻之后,反应速率
、
、
的定量关系为。
②结合图乙,反应ⅰ、ⅱ正反应的活化能、
的大小关系为(填序号,下同),反应ⅰ、ⅱ的
、
的大小关系为。
a.前者大于后者|b.前者小于后者| c.无法比较