
下列说法正确的是
 D . 反应过程中共生成4种中间产物
D . 反应过程中共生成4种中间产物

| 实验 | c0(NO)/(mol·L-l) | c0(H2)/(mol·L-l) | v正 |
| 1 | 1 | 1 | v |
| 2 | 2 | 1 | 4v |
| 3 | 1 | 2 | 2v |
| 4 | 2 | x | 16v |

|
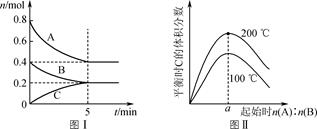
温度/ |
85 |
95 |
100 |
110~240 |
280 |
300 |
340 |
|
|
质量分数/% |
苯 |
96.05 |
91.55 |
80.85 |
1 |
23.35 |
36.90 |
72.37 |
|
环己烷 |
3.95 |
8.45 |
19.15 |
99 |
76.65 |
63.10 |
27.63 |
|
下列说法不正确的是

0.25 | 0.50 | 1.00 | 0.50 | 1.00 | ||
0.050 | 0.050 | 0.100 | 0.100 | 0.200 | 0.200 | |
v/(mol-1∙L-1∙min-1) |
下列说法正确的是( )
O2NC6H4COOC2H5+OH﹣⇌O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol•L﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
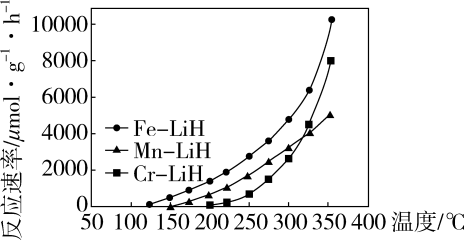
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
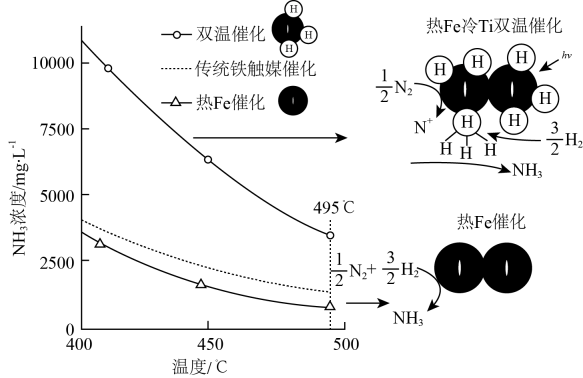
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
Ⅰ.
Ⅱ.
回答下列问题:
①当转化率达到60%时,反应达到平衡状态,这时
和
的平均相对分子质量为23,若反应Ⅱ的
, 平衡时反应速率
;
②经验公式为
, 其中
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
(用含
、
、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是。

由图可知,温度相同时选择性的实验值略高于其平衡值,可能的原因是。
a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:

已知时,
, 平衡体系总压强为P,则
反应c的平衡常数
。
反应I:CO(g)+2H2(g)⇌CH3OH(g) +Q1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) +Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
a.充入CO b.将CH3OH(g)从体系中分离 c.升高温度 d.选用新型高效催化剂
a.容器中的压强不再改变 b.混合气体的密度不再改变
c. d.消耗nmolCO2的同时生成nmolH2O(g)

①从反应压强对甲醇转化率的影响“效率”(即成本投入和产出比)考虑,工业制取甲酸甲酯应选择的压强最好是。
a.3.0×106Pa b.4.0×106Pa c.5.0×106Pa
②实际工业生产中采用的温度是80℃,其理由是。
a.加水稀释 b.加入少量甲酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
反应I:
反应II:
反应III:
反应IV:
反应V:
回答下列问题。

A.温度越高,FeO被CO还原的程度越大
B.温度越低,还原生成铁所需的
的浓度越大
C.若还原FeO活化能相对较小,则
混合气体系中的还原FeO速率由
决定
D.宜在低温下进行
②结合反应I及图示信息,说明随温度升高,在平衡体系中,与CO还原FeO的能力发生变化的原因:。
③计算576℃反应III的平衡常数K=。

已知快反应近似平衡态。若在温度为T℃下, ,
。写出T℃下
反应的速率方程:v=(用含
、
、
、a、b的代数式表示)

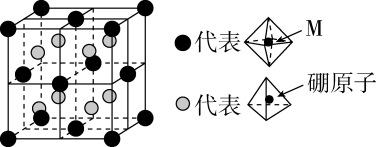
图中表示的微粒:a为,d为。

①该反应的△H (“>”或“<”)0。
②600℃时,平衡分压p(I2)= MPa,反应的平衡常数Kp= (Kp为以分压表示的平衡常数)。
第一步:I22I(快速平衡)
第二步:I+H2H2I(快速平衡)
第三步:H2I+I 2HI (慢反应)
①第一步反应 (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)•cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= (用含k1、k-1、k2…的代数式表示)。
②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=kJ·mol-1。
根据RlnKp=-+C(C为常数),由图中的数据可推知,该反应的反应热为kJ·mol-1(保留小数点后2位),图中表示的方程式是(填序号)。


①2NO=(NO)2 ΔH<0
②(NO)2+O2(g)=2NO2 ΔH<0
NO和O2反应速率公式为v=k·K·p2(NO)·p(O2),K为反应①的平衡常数,k为反应②速率常数(k随温度T升高而增大)。当其他条件不变时,研究NO达到一定转化率时,温度与时间的关系如表所示。
压强/(×105Pa) | 温度/℃ | NO达到一定转化率所需时间/s | ||
50% | 90% | 98% | ||
1 | 30 | 12.4 | 248 | 2830 |
90 | 25.3 | 508 | 5760 | |
8 | 30 | 0.19 | 3.88 | 36.4 |
90 | 0.59 | 7.86 | 74 | |
根据表中信息,对于反应:2NO+O2=2NO2 , 当其他条件一定时,升高温度,反应速率降低,原因是。

①B、E两点对应的正反应速率大小为vB(填“>”“<”或“=”)vE。
②E、F、G、H四点对应气体的平均相对分子质量最大的点为。
物质 | ||||||
相对能量(kJ·mol) | -393 | -286 | -242 | -110 | 0 | 52 |
则。

①由图可知,的催化效果好(填“M”或“N”)。
②500~800K之间,乙烯的选择性随温度变化的原因是。

①由图可知,(填“>”、“<”或“=”);已知z点体系的压强为200kPa,则
时,该反应的标准平衡常数
(保留2位小数,已知:分压=总压×该组分物质的量分数,对于反应
,
, 其中
,
、
、
、
为各组分的平衡分压)。
②已知速率方程 ,
,
、
是速率常数。图中a、b、c、d分别代表x点、z点的速率常数,其中点表示x点的
;升高温度时,
(填“增大”、“减小”或“不变”)。
①CO2(g)CO2(aq)
②CO2(aq)+H2O(l)H+(aq)+HCO
(aq) K
过程①的△H0(填“>”“<”或“=”)。溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为mol·L-1(忽略HCO和水的电离)。
反应I:C(s)+H2O(g)CO(g)+H2(g) △H1=+131.3kJ·mol-1 K1
反应II:C(s)+2H2O(g)CO2(g)+2H2(g) △H2=+90.3kJ·mol-1 K2
反应III:CO(g)+H2O(g)CO2(g)+H2(g) △H3=-41.0kJ·mol-1 K3
①上述反应的化学平衡常数随温度变化的关系如图所示,表示K1、K2、K3的曲线分别是c、、。
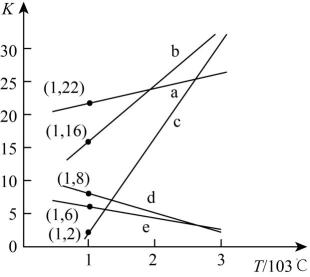
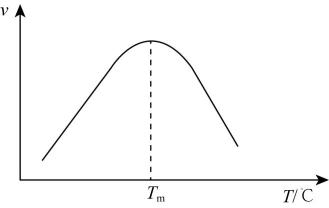
②研究表明,反应III的速率方程为:v=k[x(CO)·x(H2O)- , x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是。
主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2
温度为T℃,压强为P0的恒压密闭容器中,通入2molCH4和1molCO2发生上述反应。平衡时H2O(g)的分压为P,甲烷的转化率为40%。
①下列说法正确的是(填序号)
A.△H1和△H2不变,说明反应达到平衡状态
B.相同条件下,主反应的速率大于副反应,说明主反应的活化能小
C.选用合适的催化剂可以提高主反应的选择性,增大甲烷的平衡转化率
D.平衡后,若增大压强,主反应平衡逆向移动,副反应平衡不移动
②主反应的平衡常数Kp=(用含P和P0的计算式表示)。
②
。
则反应
。

①(填“>”“<”或“=”)0。
②B点对应温度下的平衡转化率为。
③1000℃条件下,C点的反应速率:v(正)(填“>”“<”或“=”)v(逆)。
④A点对应温度下该反应的平衡常数
歧化:
;
裂解:
。
①研究表明,温度和压强对积碳反应中平衡碳量的影响如图a和图b所示,其中表示温度和压强对的裂解反应中平衡碳量影响的是(填“图a”或“图b”),简述所选择该图的理由:。
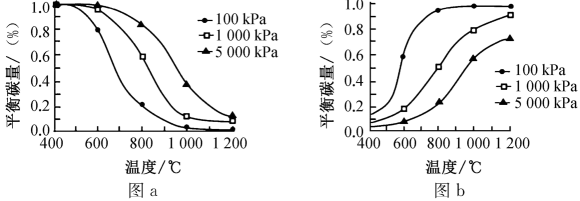
②在重整反应中,低温、高压时会有显著积碳产生,由此可推断,该条件下,对于该重整反应而言,其积碳主要由(填“歧化”或“
裂解”)反应产生。
③研究发现,产生积碳反应除歧化、
裂解外,
与
,
与
之间反应也可产生积碳,写出相应的化学方程式:(任写一个)。
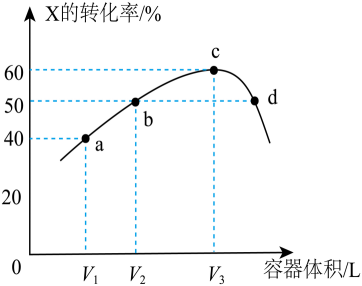
在一定条件下,CO2和H2混和气体共0.5mol(体积比1:4),在2L恒容密闭容器中进行的反应可能有下列反应I和II,经反应相同时间测得“CO2转化率”、CH4和CO“选择性”随温度变化情况分别如图1和图2所示(选择性即转化的CO2中生成CH4或CO的百分比)。

反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g)
反应II:CO2(g)+H2(g)CO(g)+H2O(g)
a.反应I是放热反应
b.温度可影响产物的选择性
c.CO2平衡转化率随温度升高先增大后减少
d.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I经10min达到平衡,则从起始到平衡,υ(CO2)=mol·L-1·min-1;
I.CH2=CHCH=CH2(g)+2H2(g)⇌CH3CH2CH2CH3(g) ∆H1
Il.CH3C≡CCH3(g)+2H2(g)⇌CH3CH2CH2CH3(g) ∆H2
III.CH3C≡CCH3(g)⇌CH2=CHCH=CH2(g) ∆H3
回答下列问题;
①0~10min内,反应的平均速率v(H2)=
②反应I的平衡常数Kc(I)=(保留三位有效数字)。
③10min后,若再向容器中充入1molCH3CH2CH2CH3(g),则CH3CH2CH2CH3(g)的平衡转化率80%(填“>”“<”或“=”)。
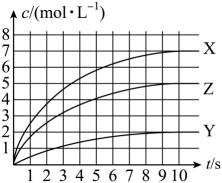
④保持温度不变,起始向恒容密闭容器中充入一定量的CH2=CHCH=CH2(g)、CH3C≡CCH3(g)和H2(g),实验测得CH2=CHCH=CH2(g)、CH3C≡CCH3(g)的浓度与时间的关系如图1所示。其中表示CH3C≡CCH3(g)的浓度与时间关系的曲线为(填“L1”或“L2");t0min时,反应III向(填“正反应”或“逆反应”)方向进行,理由为。

⑤反应III的平衡常数lgKc(III)与温度的倒数1/T的关系如图2所示。则∆H1∆H2(填“>”“<"或“=”),原因为。

|
溶剂 |
溶剂分子的极性参数 |
反应温度/℃ |
CH2BrCH=CHCH2Br的物质的量分数/% |
CH2=CHCHBrCH2Br的物质的量分数/% |
|
氯仿 |
4.1 |
-15 |
63 |
37 |
|
正己烷 |
0.0 |
-15 |
38 |
62 |
②
③
则反应 的
。

| t/min | 0 | 20 | 40 | 60 | 80 | 100 |
| | 0.100 | 0.080 | 0.060 | 0.040 | 0.020 | 0.000 |
速率方程中k=,保持其他条件不变,若起始浓度为 ,则半衰期(浓度减少一半所需的时间)=min。


①结合图1中的信息,写出总反应的化学方程式。用氢气进行脱硫的优点是。
②已知在反应过程中,过量的H2可发生副反应:xH2(g)+SX(g)xH2S(g),图2中的两条曲线分别代表SO2的转化率或Sx的选择性随H2和SO2体积比[V(H2)/V(SO2)]的变化情况(Sx的选择性:SO2还原产物中Sx所占的体积百分比),可推断曲线(填“L1“或“L2”)代表Sx的选择性,理由是。
③现有3molH2和1molSO2在上述条件下反应,其中SO2的转化率或Sx的选择性的结果如图2所示,则剩余的SO2的物质的量mol,H2的物质的量mol。

由图可知该反应为放热反应,解释图3中温度小于350℃时,转化率随温度升高而增大的原因是。在图3中A、B、C、D四点对应的条件中,你认为(填“A、B、C、D”)是最佳条件,其原因可能是。