
已知氯气溶解存在以下过程:
①Cl2(aq)+H2O(l)H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
②Cl2(aq)+Cl-(aq)Cl
(aq) K2=0.19
③HClO(aq)H+(aq)+ClO-(aq) Ka=3.2×10-8
下列说法错误的是( )
实验目的 | 实验方案 | 现象和结论 | |
A | 探究乙醇消去反应的产物 | C2H5OH与浓硫酸(体积比约为1:3)的混合液,放入几块碎瓷片,170℃共热,将产生的气体通入酸性KMnO4溶液中 | 若酸性KMnO4溶液褪色,则乙醇消去反应的产物为乙烯 |
B | 探究乙酰水杨酸( 样品中是否含有水杨酸( | 取少量样品,加入3mL蒸馏水和少量乙醇,振荡,再加入1-2滴FeCl3溶液 | 若有紫色沉淀生成,则该样品中含有水杨酸 |
C | 探究麦芽糖是否发生水解 | 取2mL20%的麦芽糖溶液于试管中,加入适量稀H2SO4后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制Cu(OH)2悬浊液并加热煮沸 | 若生成砖红色沉淀,则麦芽糖已水解 |
D | 探究KI与FeCl3反应的限度 | 取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
物质 | 熔点 | 沸点 |
偏二甲肼 | -58℃ | 63.9℃ |
肼 | 1.4℃ | 113.5℃ |
偏二甲肼中氮原子的杂化方式为,二者熔沸点存在差异的主要原因是。


铁酸钇的化学式为。已知1号O原子分数坐标为(0,0,),2号O原子分数坐标为(
,
-m,
-n),则3号Fe原子的分数坐标为。已知铁酸钇的摩尔质量为Mg·mol-1 , 晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 该晶胞的体积为pm3(列出表达式)。

方案一:SO2还原氯化铜制备CuCl。
装置乙中发生反应的离子方程式为。反应完成后将乙中混合物过滤、洗涤、干燥。“过滤”操作最好选用下列装置中的(填字母),“洗涤”时用乙醇代替蒸馏水的优点是。

方案二:高温加热分解氯化铜晶体(CuCl2·xH2O)制备CuCl,装置如图(加热及夹持仪器省略)。

准确称取氯化亚铜产品mg,溶于过量的FeCl3溶液中得V1mL待测液,从中量取V2mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-l硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2溶液bmL。产品中CuCl的质量分数为%。
(已知:CuCl+Fe3+=Cu2++Fe2++Cl- , Fe2++Ce4+=Fe3++Ce3+)
下列有关滴定的说法错误的是(填字母)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低

回答下列问题:
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是(填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为mol·L-1(保留2位有效数字)。

已知:①D分子结构中含有醛基
② +
+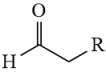
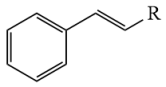 +H2O
+H2O
回答下列问题:
①苯环上有两个取代基
②含有—NH2
③能与FeCl3溶液发生显色反应且能发生银镜反应
 和
和 (Ar为芳基)制备
(Ar为芳基)制备 的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。
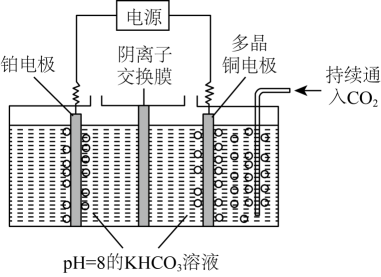
①CO2(g)CO2(aq)
②CO2(aq)+H2O(l)H+(aq)+HCO
(aq) K
过程①的△H0(填“>”“<”或“=”)。溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为mol·L-1(忽略HCO和水的电离)。
反应I:C(s)+H2O(g)CO(g)+H2(g) △H1=+131.3kJ·mol-1 K1
反应II:C(s)+2H2O(g)CO2(g)+2H2(g) △H2=+90.3kJ·mol-1 K2
反应III:CO(g)+H2O(g)CO2(g)+H2(g) △H3=-41.0kJ·mol-1 K3
①上述反应的化学平衡常数随温度变化的关系如图所示,表示K1、K2、K3的曲线分别是c、、。
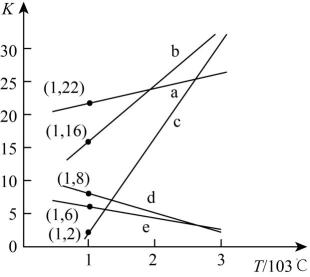
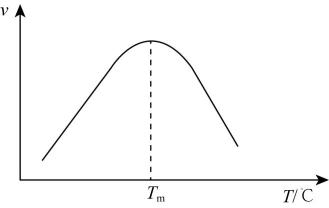
②研究表明,反应III的速率方程为:v=k[x(CO)·x(H2O)- , x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是。
主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2
温度为T℃,压强为P0的恒压密闭容器中,通入2molCH4和1molCO2发生上述反应。平衡时H2O(g)的分压为P,甲烷的转化率为40%。
①下列说法正确的是(填序号)
A.△H1和△H2不变,说明反应达到平衡状态
B.相同条件下,主反应的速率大于副反应,说明主反应的活化能小
C.选用合适的催化剂可以提高主反应的选择性,增大甲烷的平衡转化率
D.平衡后,若增大压强,主反应平衡逆向移动,副反应平衡不移动
②主反应的平衡常数Kp=(用含P和P0的计算式表示)。