①CO2(g)CO2(aq)
②CO2(aq)+H2O(l)H+(aq)+HCO
(aq) K
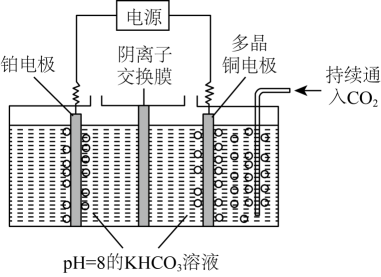
过程①的△H0(填“>”“<”或“=”)。溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为mol·L-1(忽略HCO和水的电离)。
反应I:C(s)+H2O(g)CO(g)+H2(g) △H1=+131.3kJ·mol-1 K1
反应II:C(s)+2H2O(g)CO2(g)+2H2(g) △H2=+90.3kJ·mol-1 K2
反应III:CO(g)+H2O(g)CO2(g)+H2(g) △H3=-41.0kJ·mol-1 K3
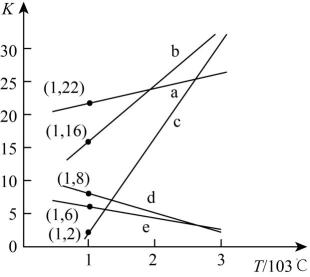
①上述反应的化学平衡常数随温度变化的关系如图所示,表示K1、K2、K3的曲线分别是c、、。
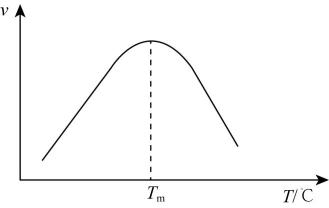
②研究表明,反应III的速率方程为:v=k[x(CO)·x(H2O)- , x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是。
主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2
温度为T℃,压强为P0的恒压密闭容器中,通入2molCH4和1molCO2发生上述反应。平衡时H2O(g)的分压为P,甲烷的转化率为40%。
①下列说法正确的是(填序号)
A.△H1和△H2不变,说明反应达到平衡状态
B.相同条件下,主反应的速率大于副反应,说明主反应的活化能小
C.选用合适的催化剂可以提高主反应的选择性,增大甲烷的平衡转化率
D.平衡后,若增大压强,主反应平衡逆向移动,副反应平衡不移动
②主反应的平衡常数Kp=(用含P和P0的计算式表示)。