
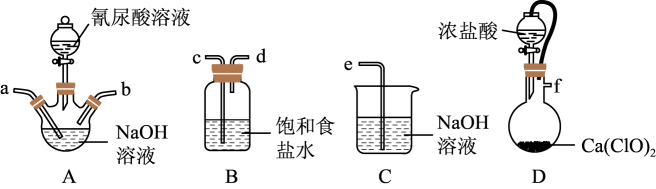
实验目的 | 实验操作 | |
A | 配制FeCl3溶液 | 用浓盐酸溶解FeCl3固体再加适量蒸馏水 |
B | 制取NaHCO3 | 将NH3通入CO2和NaCl的饱和溶液中 |
C | 制备Fe(OH)3胶体 | 将NaOH溶液滴加在新制的Fe2(SO4)3溶液中 |
D | 测定“84”消毒液的pH | 用玻璃棒蘸取溶液点在pH试纸上 |


已知:Mn(II)在酸性环境中较稳定,在碱性环境中易被氧化;在酸性溶液中钒通常以、
等存在;沉铬过程中,当溶液
时,开始出现沉淀,此时铬离子浓度为
。下列说法正确的是


已知:①焙烧时过量的分解为
,
转变为
;
②金属活动性:;
③相关金属离子形成氢氧化物的范围如下:
开始沉淀 | 完全沉淀 | |
6.5 | 8.3 | |
1.6 | 2.8 | |
8.1 | 10.1 |
回答下列问题:
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
将与液体
混合并加热,制得无水
。已知
沸点为77℃,反应方程式为:
, 装置如下图所示(夹持和加热装置略)。

仪器A的名称为,其作用为。NaOH溶液的作用是。
a. b.
c.

Sn与Si同族,25℃时相关的溶度积见表。
化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+ , 且无气体生成,则生成的硝酸盐是,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2 , 焙烧时,与NaOH反应的化学方程式为。
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于mol•L-1。
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+ , 再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO被还原为I— , 终点时消耗KIO3溶液20.00mL。
①终点时的现象为,产生I2的离子反应方程式为。
②产品中Sn的质量分数为%。

①存贮时,Na应保存在中。
②冷凝水的进口是(填“a”或“b”)。
③用Na干燥甲苯的原理是(用化学方程式表示)。
④回流过程中,除水时打开的活塞是;体系变蓝后,改变开关状态收集甲苯。

①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加热12小时,反应物完全反应。其化学反应方程式为。用Ar气赶走空气的目的是。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是和。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为kPa,需NaN3的物质的量为mol(保留3位小数)。已知:p=a×n,其中a=2.5×105kPa•mol-1 , n为气体产物的物质的量。


回答下列问题:

时相关物质的参数如下:
的溶解度:
化合物 | |

回答下列问题:

已知:Ksp(BaCO3)=5.1×10-9 , Ksp(BaCrO4)=1.2×10-10 , Ksp(CaCrO4)=2.3×10-2;“净化液”中溶质只含有NaVO3、Na2CrO4。
请回答下列问题:

I.将邻苯二甲酸酐(C8H4O3)与苯酚(C6H5OH)在b中混合,在剧烈搅拌下,缓慢滴加约2mL浓硫酸,加热至150℃进行反应,待b内固体反应物全部熔融为澄清的液态混合物后,停止加热。
II.装置冷却后,量取40mL稀硫酸,在揽拌下加入b中,从溶液中析出粗品酚酞后,抽滤混合物。
III.将粗品酚酞置于烧杯中,加适量水溶解,在不断搅拌下滴加饱和碳酸钠溶液。
IV.继续加入足量碳酸钠溶液,并加入适量水,搅拌。
V.抽滤烧杯中的混合物,洗涤滤渣,合并洗涤液,得到酚酞盐(A2-)溶液。
VI.将溶液转移至大烧杯中,在搅拌下滴加浓盐酸,直到红色褪去,出现白色浑浊,抽滤,滤渣为不溶的杂质。
VII.将滤液转移至大烧杯中,在搅拌下继续滴加浓盐酸,最终析出白色晶体,抽滤、洗涤得纯净的酚酞。
请回答下列问题:

B为直型管式电阻炉,880℃时,该装置内先后发生以下反应:
I.
II.
已知:
颜色 | 暗紫色 | 紫红色 | 无色 | 无色 |
在反应装置内的状态 | 固态 | 气态 | 气态 | 气态 |
请回答:
滴定原理:利用将产物中三价钛氧化为四价,然后用
滴定剩余的
。
已知:实验室现有的含有
杂质。
①从下列选项中选择最佳操作并排序(部分操作可重复使用)完成实验:
I.;
II.。

a.转移至100mL容量瓶并定容
b.加入 (过量),30mL浓磷酸和5mL浓硫酸
c.静置,观察颜色变化
d.取20.00mL待测液,加入指示剂,用标准液滴定
e.另称取 , 加入30mL浓磷酸和5mL浓硫酸
②实验I中在进行d操作时,不慎将标准液滴出锥形瓶,将导致测定的
质量分数。(填“偏高”、“偏低”、“无影响”)
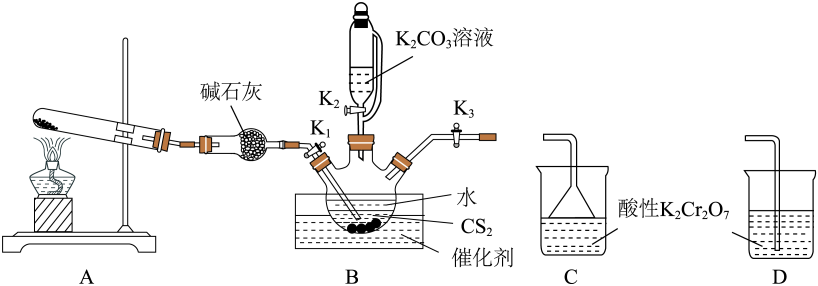
已知:CS2不溶于水,密度比水大;NH3不溶于CS2。
实验步骤如下:
关闭K1、K3 , 打开K2 , 依据滴液漏斗中的水能否顺利流下检查装置B的气密性是否合理 。(填“合理”或“不合理”)
检查装置的气密性良好,向三颈烧瓶内加入CS2、水和催化剂,CS2液体必须浸没导气管口,实验开始时打开K1 , 关闭K2、K3 , 加热装置A、B.回答下列问题:
装置A中的大试管可以盛放的试剂为 ____。( 填序号)
移去A处的酒精灯,关闭K1 , 将B与C或D连接,打开K3 , 移开水浴装置,将装置B继续加热至105 ℃,使NH4HS完全分解(产生两种气体),然后再打开K2 , 缓慢滴入K2CO3溶液,持续加热充分反应生成产品的同时产生两种气体,反应结束后先滤去三颈烧瓶中的固体催化剂,再蒸发浓缩、冷却结晶、过滤、干燥,得到硫氰化钾晶体粗产品。
B应和(填C或 D)连接。
实验编号 | 试剂a | 实验现象 |
i |
| 无明显现象 |
ii |
| 得到紫色溶液,无紫色固体 |
iii |
| 得到深紫色溶液,有紫色固体 |
①对比实验i与ii现象,提出假设;“实验ii溶液碱性较强,、增强+3价铁的还原性”验证此假设的实验装置如图所示:

当通入 , 电压表示数为
;再向右侧烧杯中加入的试剂为,电压表示数为
;且观察
(填“>”“<”或“=”)证明上述假设成立。
②配平实验iii中反应的离子方程式:
□□
□
□
□
□
③实验ii中的产率比实验iii的低,其原因可能是。
①结合化学用语解释该现象:;
②若拆除装置B,而使的产率降低的原因是。
步骤i:氯气通入过量的烧碱溶液中制备NaClO溶液;
步骤ii:NaClO碱性溶液与过量CO(NH2)2(尿素)水溶液在加热条件下生成水合肼;
步骤iii:减压蒸馏,获得水合肼。回答下列问题:




已知:环己醇相对分子质量为100,熔点为24℃,沸点为161 ℃,密度为0.95 g/mL;己二酸相对分子质量为146,微溶于水,且温度越低溶解度越小。
实验步骤如下:
i.向三颈瓶中加入3. 5 g碳酸钠和50 mL温水,在搅拌下加入10 g高锰酸钾。
ii.待高锰酸钾溶解后,用滴管慢慢加入2.6 mL环己醇,维持反应温度在43〜47℃之间。
iii.环己醇滴加完毕,待反应完成,使二氧化锰沉淀凝结,然后加适量固体亚硫酸氢钠除去过量的高锰酸钾。
iv.趁热抽滤,滤渣用热水洗涤三次,合并滤液与洗涤液,用浓盐酸调pH至1〜2。
v.将滤液加热浓缩至20 mL左右,冷却,结晶,抽滤,洗涤,干燥,称重(得到产品1.5 g),计算产率。
请回答下列问题:
使用改进后的装置,考查了步骤ii中滴加速度分别为6、18、25 s •滴-1共3种情况下的反应状况、滤渣和滤液及产品性状。见下表所示。
滴加时间 /min | 滴加速度 /(s •滴-1) | 反应过程监控 | 滤渣 | 滤液 | 产品性状 |
20 | 6 | 7 min,T=100℃,发生冲料;20 min滴加完,反应完成 | 黑色,偏褐色,量大 | 澄清透明, 偏黄绿色 | 量少,乳白 色,稍黄 |
60 | 18 | Tmax =74℃环己醇滴加完T =44℃ ,60 min反应完成 | 黑色固体 | 无色,澄清, 透明 | 无色晶体 |
90 | 25 | 13min,温度没有变化;23min,T=40℃;Tmax=53℃;环己醇滴加完,T=41℃反应不完全,水浴加热20min,反应完成 | 黑色固体 | 无色,澄清, 透明 | 无色片状晶体,晶型很漂亮 |

已知:①滤渣I主要成分是难溶于水的Ce(BF4)3;
②常温下,Ka1(H2CO3) =4.3×10-7 , Ka2(H2CO3) =5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×1.0-28;
③Ce3 +在空气中易被氧化为Ce4+。
回答下列问题:

已知:铼的最高价氧化物为酸性氧化物,能与水反应生成对应的酸。在碱性溶液中, 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成
。
回答下列问题:

已知:①常温下,Ksp(CuS)=8.9×10-36 , Ksp(CoS)=1.8×10-22。
②溶液的氧化还原电位为正表示该溶液显示出一定的氧化性。氧化还原电位越高,氧化性越强;电位越低,氧化性越弱。
回答下列问题:


已知:
金属阳离子 | 开始沉淀的pH | 完全沉淀的pH |
Cu2+ | 4.8 | 6.4 |
Fe3+ | 2.7 | 3.7 |
根据以上信息回答下列问题:
A. B.
B. C.
C. D.
D.
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为→→E→(填标号)。

下列有关抽滤的说法错误的是(填标号)。
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是。
 ),则Cu2(CO)2Cl2·2H2O中的配位体为(填化学式)。
),则Cu2(CO)2Cl2·2H2O中的配位体为(填化学式)。

注明:PVP为聚乙烯吡咯烷酮,2 - MIM为2-甲基咪唑(C4H6N2),ZIF- 8为金属有机框架。