| 编号 | 实验目的 | 实验过程 |
| A | 配制0.4000mol.L-1的溶液 | 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C | 制取并纯化氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 的KMnO4溶液 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
编号 | 实验操作 | 目的 |
A | 取4gNaOH加入96mL水中(水的密度近似看作1g/cm3) | 配制4%的NaOH溶液 |
B | 配制一定物质的量浓度的溶液实验中,用蒸馏水润洗容量瓶 | 避免造成误差,且不会使所配制溶液浓度偏低 |
C | 向盛有铜片的试管中加入浓硫酸,加热 | 证明浓硫酸具有强氧化性 |
D | 将SO2通入溴水中, 溶液褪色 | 证明SO2具有漂白性 |
 B .
B .  C .
C .  D .
D . 
①用10mL量筒准确量取稀硫酸溶液8.0mL;
②用干燥的pH试纸测定氯水的pH;
③能说明亚硝酸是弱电解质的是:用HNO2溶液作导电试验,灯泡很暗;
④使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大;
⑤将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体;
⑥圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上;
⑦除去铁粉中混有的少量铝粉.可加入过量的氢氧化钠溶液,完全反应后过滤;
⑧为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量;
⑨用食醋除去水壶中的水垢.
 B .
B .  D .
D . 
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③ | ④,有刺激性气体产生 |
⑤静置, | ⑥ |
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32﹣+I2=2I﹣+S4O62﹣).
回答下列问题:
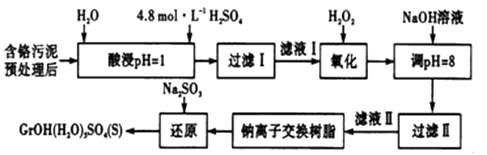
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
|
阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
|
开始沉淀时的pH |
2.7 |
— |
— |
|
沉淀完全时的pH |
3.7 |
11.1 |
8 |
其中硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。

I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4 向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62- )。
步骤5....
步骤6 数据处理,计算黑灰中BaS含量。
酸性矿井水( 主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/L BaCl2溶液)
 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化  测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
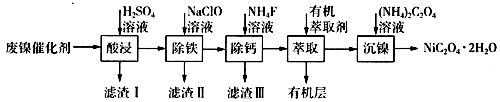

①若控制温度40℃、pH=8,则滤渣II的主要成分为(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:。
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要。
②该镀镍试剂的化学式为。
A.200mL
B.300mL
C.400mL
D.500mL
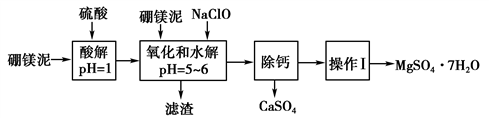
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,,便得到了MgSO4·7H2O。

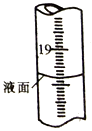
②定容时仰视刻度线,;填“偏高”、“偏低”或“无影响”);
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2~3次,将洗涤液倒入烧杯中,.(填“偏高”、“偏低”或“无影响”);
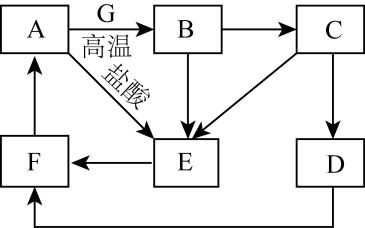
回答下列问题:
①在配制C溶液时需加入少量铁屑,其目的是。
②在配制过程中,下列不正确操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:;
b、烧杯和玻璃棒未洗涤:;
c、定容时俯视刻度线:。
物质 用途 A.氧化铁 a.作红色颜料 B.次氯酸钠 b.作食用碱 C.碳酸钠 c.漂白剂 |
①该反应中作还原剂的物质是。
②若反应中消耗了0.2mol则生成
的物质的量为mol,转移电子的物质的量为mol。
实验步骤 | 实验仪器 |
a.将称量好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。 b.根据计算结果,称量NaCl固体。 c.计算需要的NaCl固体的质量 d.将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。 e.将配制好的溶液倒入试剂瓶中,并贴好标签。 f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。 | 量筒 托盘天平 圆底烧瓶 100mL容量瓶 烧杯 玻璃棒 胶头滴管 |
①计算需要NaCl固体的质量为g。
②配制过程中不需要使用的仪器是。
③配制溶液时,正确的实验操作顺序是c-b。
④定容时俯视容量瓶刻度线,会导致所配制的NaCl溶液浓度。(填“偏大”或“偏小”)
①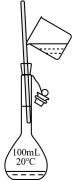 ②
② ③
③
a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
j |
①月壤中含有较丰富的质量数为3的a,它可以作为未来核聚变的重要原料之一,a的这种核素表示为。
②经分析,月壤中含有大量的元素d和h,原子半径dh,元素h在周期表中的位置为。

在配制过程中需要用到的玻璃仪器有100mL容量瓶、胶头滴管、量筒、和。

请回答:
仪器a的名称是。