 C .
C .  D . 苯的分子结构模型
D . 苯的分子结构模型
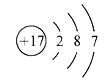
①基态X原子的结构示意图为![]()
②基态的价电子排布式为
③基态的轨道表示式为
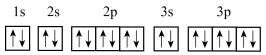
④基态的最高能级的电子对数等于其最高能层的电子层数
 D . 乙烯的结构简式:
D . 乙烯的结构简式: D . Fe2+的价电子排布式为:[Ar]3d54s1
D . Fe2+的价电子排布式为:[Ar]3d54s1
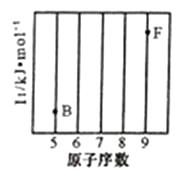
 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )
H2(g)+ O2(g)=H2O(l)△H2
2As(s)+ O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=.
298K时,将20mL 3x mol•L﹣1 Na3AsO3、20mL 3x mol•L﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣⇌AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y mol•L﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是.
④若平衡时溶液的pH=14,则该反应的平衡常数K为.

①用少量的KSCN溶液,生成红色的[Fe(SCN)H2O)5]2+。O、N、S三种元素的电负性由大到小的顺序为,在SCN-中C的杂化方式,写出一个与其互为等电子体的分子。
②用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3pben=[Fe(phen)3]2+。[Fe(phen)3]2+中Fe2+的配位数为,存在的化学键有(填序号)。

a.配位键 b.离子键 c.π键 d.氢键
③用邻二氨菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释pH不能太小的原因。

①结构中原子坐标参数A为(0,0,0),氮原子为( ,
,
),则B坐标参数为。
②计算该晶体密度为g·cm-3。
请回答与这两种物质中元素有关的一些问题。

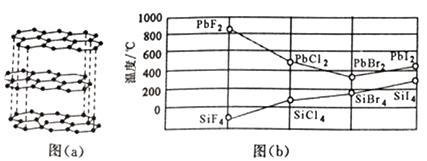
a.离子晶体
b.分子晶体
c.原子晶体
d.金属晶体

晶体R 中含有的化学键包括。



酸浸时,FeCO3与硫酸反应的化学方程式为,为了提高浸取率可采取的措施有(填字母)。
a.多次用废硫酸浸取
b.减小盐泥粒度并充分搅拌
c.适当延长浸取时间
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为;第四周期元素中,最外层电子数与铜相同的元素还有。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因。
③下列分子属于非极性分子的是。
a.甲烷
b.二氯甲烷
c.苯
d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是;酞菁铜分子中心原子的配位数为。

⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):

它的化学式可表示为;在Au周围最近并距离相等的Cu有个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为g/cm3。(阿伏加德罗常数用NA表示)



①充电时,b为电源的(填“正极”或“负极”)。
②放电时,正极的电极反应式为。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
四 | ⑩ | |||||||

已知:X为元素周期表中相对原子质量最小的元素,B为氮元素。请回答下列问题:
a.金属性:E>G b.氢化物的稳定性:D最高价氧化物的水化物酸性:L
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
① |
|||||||
|
2 |
② |
③ |
④ |
|||||
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
||
|
4 |
A 比较这两种元素单质的沸点
B 比较这两种元素单质与氢气化合的难易
C 比较这两种元素的最高价氧化物对应水化物的酸性
|
X |
L层电子数是K层电子数的3倍 |
|
Y |
核外电子层数等于原子序数 |
|
Z |
L层电子数是K层和M层电子数之和 |
|
W |
最外层电子数是次外层电子数的2.5倍 |

部分金属氢氧化物Ksp近似值如下表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
H2(g)+ O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。 ②H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+的电离常数为Ka1 , 则pKa1=(pKa1 = -lg Ka1 )。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH0(填“>”或“<”)。

图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=。



请分析1个松脂酸铜中π键的个数;加“*”碳原子的杂化方式为。


②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为.
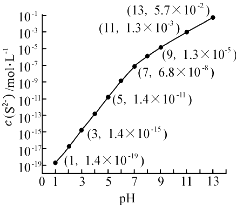
①pH=13时,溶液中的c(H2S)+c(HS﹣)=mol•L﹣1 .
②某溶液含0.020mol•L﹣1Mn2+、0.10mol•L﹣1H2S,当溶液pH=时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10﹣13]
|
|
Ka1 |
Ka2 |
|
H2SO3 |
1.3×10﹣2 |
6.3×10﹣8 |
|
H2CO3 |
4.2×10﹣7 |
5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K=.
②0.10mol•L﹣1Na2SO3溶液中离子浓度由大到小的顺序为.
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为.