







NO+NO2+2OH−=2 +H2O
2NO2+2OH−= +
+H2O
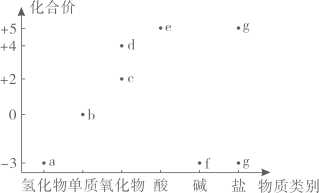
①下列措施能提高尾气中NO和NO2去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
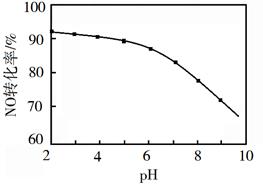
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是。
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=,联氨和N2O4可作为火箭推进剂的主要原因为.
称取100g土壤于烧杯中,加入足量浓硫酸和一定量的催化剂,充分反应后过滤、洗涤滤渣,往滤液加入足量NaOH溶液,按如图进行蒸馏,用过量硼酸吸收生成的氨。

已知:常温下,
土壤中的氮元素主要存在形式。(填微粒符号)
将锥形瓶内溶液稀释至250mL,取出25.00mL稀释液,向其中滴加2~3滴甲基红(变色范围4.4~6.2),用盐酸标准溶液滴定。重复实验3次,平均消耗盐酸标准溶液18.00mL。
滴定时,发生反应的离子方程式为。
a.所处的电子亚层相同 b.自旋方向相同
c.占据的轨道相同 d.运动状态相同
_NO+__
_
_
若反应所得的氧化产物比还原产物多1.5mol,则该反应转移的电子为mol。

①两步反应的最佳温度为35℃,当温度低于5℃,反应接近停止的原因是;
②步骤I中若的消除速率为
, 则
的消耗速率为
;
①吹脱时,与
在溶液中存在下述平衡:
, 如图是不同温度下,水中
与
随
变化的相对含量图:

由图像可知,越大,水中
含量越高,其原因是。50℃平衡
的平衡常数
;
②氧化原理如下:

(i)其他条件相同时,向一定体积的氨氮废水中通入 , 根据上述原理推测下列说法错误的是(填代号);
a.该过程中N元素既有被氧化的过程又有被还原的过程
b.优良的催化剂不但能降低的活化温度,还能提升
的平衡转化率
c.单位时间内生成的活性氧(O·)越多,对转化为无害物越有利
d.随着温度升高、单位时间内的转化率提升说明该转化一定是吸热反应
(ii)其他条件相同,不同催化剂X、Y在发生催化作用时,对比结果如下:
催化剂 | 转化温度(℃) |
|
|
X | 250 | 90 | 50 |
Y | 225 | 90 | 90 |
X催化剂Y催化剂(填“优于”或“劣于”);
其原理为电解时阳极产生的羟基自由基氧化或
成为
而被去除。实验结果表明,当溶液中存在
时,
或
转化率大幅提升(如图所示),其可能的原因是。

已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=。
在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。

①已知T2>T1 , 则反应ΔH0(填“>”、“=”或“<”)。
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施(填字母序号)。
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=;若其他条件不变,升高温度,用分压表示的平衡常数Kp(填“变大”、“变小”或“不变”)。
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中点(填A~F)。
新型催化剂b在含有少量O2条件下,能催化NH3 , 和NOx , 反应生成N2 , 且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。

①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是。
②当温度高于300℃时,NOx除去率迅速下降的原因是。

编号 | c(NaOH) | 现象 |
甲 | 2mol•L-1 | 活塞自动内移,最终剩余约7mL无色气体 |
乙 | 6mol•L-1 | 活塞自动内移,最终气体全部被吸收 |
【查阅资料】
i.NO2遇水时发生反应:a.
b. ;
ii.酸性条件下,或
可与对氨基苯残酸发生不可逆反应,所得产物遇萘乙二胺变红,且原溶液中
越大,红色越深。
【实验】将2mLNO2推入5mL下列试剂中,随即取出0.1mL溶液,滴加到等量对氨基苯磺酸溶液(盐酸酸化)中,再加入等量萘乙二胺溶液,加水定容到相同体积,对比溶液颜色。
编号 | 试剂 | 溶液颜色 |
丙 | 水 | 溶液均呈红色,丁与戊颜色几乎相同,丙的颜色更浅 |
丁 | 6mol•L-1NaOH溶液 | |
戊 | 酸性对氨基苯磺酸溶液 |
①通过实验(填编号)对比,说明NO2遇水时发生了反应a和b。
②从化学反应速率的角度分析,NO2与水或碱反应时还原产物价态不同的原因是。
综上,用NaOH溶液吸收NO2尾气,适宜的条件是(写出两点即可)。

已知:
①不用盐酸调节NaClO溶液初始pH的原因是。
②将pH=3.5时NaClO溶液脱除NO的离子方程式补充完整:。
□NO+□ +□ □
□
□
③pH<5.5时,分析脱除率随溶液初始pH升高而增大的可能原因:。

检测前,电解质溶液中的保持定值时,电解池不工作。
进入电解池后与
反应,库仑仪便立即自动进行电解到
又回到原定值,测定结束。通过测定电解消耗的电量可以求出
的物质的量。
①在电解池中被
还原为NO的离子方程式为。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。脱除率是。
③测量结束后,电解池中还检测到少量和
, 这将导致
测定结果(填“偏高”或“偏低”),需进行校正。


已知:A的相对分子质量为62,在氧气中灼烧可得物质的量之比为2:1的两种气体;钠汞齐是单质钠溶于单质汞形成混合物,是一种强还原剂;B、E含有相同的阴离子。
请回答: