操作及现象 | 结论 | |
A | 向溶有SO2的BaCl2溶液中加入Fe(NO3)3溶液,有白色沉淀生成 | 说明NO |
B | 向2mL浓度均为0.1mol•L-1的NaBr与Na2S混合溶液中滴加2滴0.1mol•L-1的AgNO3溶液,只有黑色沉淀生成 | 说明Ag2S比AgBr更难溶 |
C | 取4mL乙醇,加入12mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体进入2mL溴水中,溴水褪色 | 说明乙醇消去反应的产物为乙烯 |
D | 向丙烯醛中加入足量新制氢氧化铜悬浊液,加热至不再生成砖红色沉淀,静置,向上层清液滴加溴水,溴水褪色 | 说明丙烯醛中含有碳碳双键 |
①已知Co(NH3)5BrSO4中Co(III)的配位数为6,向该配合物的溶液中滴加BaCl2溶液,无明显现象,则该配合物可表示为。
②[Co(NH3)6]3+结构如图所示,Co3+位于正八面体中心,若其中两个NH3被Cl-取代,则[Co(NH3)4Cl2]-的空间结构有种。

②负极材料LiC6晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为mpm。石墨层间距为npm。该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数的值)。

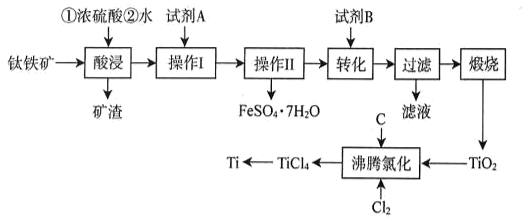
已知:①TiO2+易水解,只能存在于强酸性溶液中;高温下Ti易与N2 , H2反应。
②25℃时相关物质的Ksp见表:
物质 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | TiO(OH)2 |
Ksp | 1.0×10-16.3 | 1.0×10-38.6 | 1.0×10-11.6 | 1.0×10-29 |
回答下列问题:
①试剂B为(填标号)。
A.H2SO4 B.H2O2 C.Na2CO3 D.NH4Cl
②为沉钛完全[c(TiO2+)≤1.0×10-5mol•L-1]需要调节溶液的pH略大于。
物质 | TiCl4 | Cl2 | CO | CO2 |
分压MPa | 4.59×10-2 | 4.98×10-9 | 1.84×10-2 | 3.70×10-2 |
该温度下,TiO2与C、Cl2反应的总化学方程式为。
过程:V2O5VOCl2溶液
氧钒(IV)碱式碳酸铵粗产品
已知VO2+能被O2氧化,回答下列问题:

①仪器b的名称为,仪器c除冷凝回流外,另一作用为。
②步骤I生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为。

①接口的连接顺序为a→。
②实验开始时,先关闭K2 , 打开K1 , 当时(写实验现象),再关闭K1 , 打开K2 , 充分反应,静置,得到固体。
称取mg样品用稀硫酸溶解后,加入过量的0.02mol•L-1KMnO4溶液,充分反应后加入过量的NaNO2溶液,再加适量尿素除去NaNO2 , 用cmol•L-1(NH4)2Fe(SO4)2标准溶液滴定达终点时,消耗体积为VmL。(已知:VO+Fe2++2H+=VO2++Fe3++H2O)
①样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为。
②下列情况会导致产品纯度偏大的是(填标号)。
A.未加尿素,直接进行滴定
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成

回答下列问题:
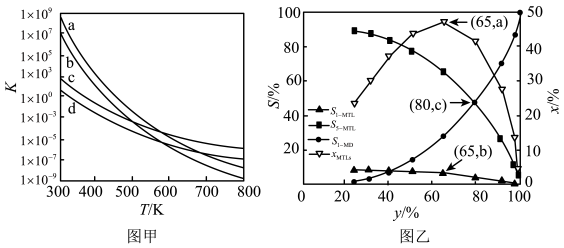
①c、d分别为反应R1和R3的平衡常数随温度变化的曲线,则表示反应R2的平衡常数随温度变化曲线为。
②已知反应R1的速率方程v正=k正•c(1-MN)•c2(H2),v逆=k逆•c(5-MTL)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。温度T1下反应达到平衡时k正=1.5k逆 , 温度T2下反应达到平衡时k正=3k逆。由此推知,T1T2(填“>”,“<”或“=”)。
③下列说法错误的是。
A.四个反应均为放热反应 B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1-MD最稳定 D.由上述信息可知,400K时反应R4速率最快