|
物质(g) |
O |
H |
|
|
|
|
|
|
|
能量/ |
249 |
218 |
39 |
10 |
0 |
0 |
|
|
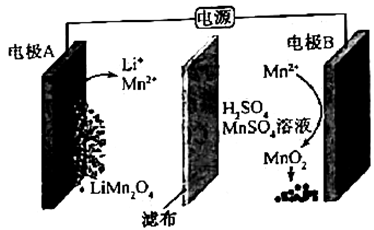
可根据计算出
中氧氧单键的键能为
。下列说法不正确的是( )

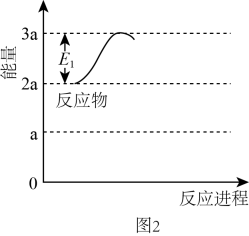
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
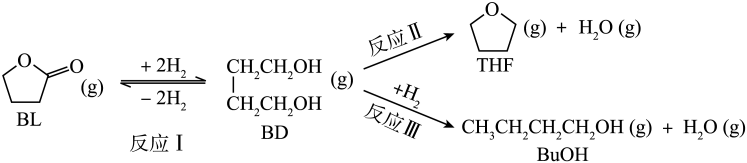
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故
压强近似等于总压。回答下列问题:
在某温度下达到平衡,测得密闭系统中各组分浓度分别为、
、
, 计算该温度下的平衡常数K=。
Ⅰ
Ⅱ
总反应:
Ⅲ
投料按体积之比 , 并用
稀释;常压、不同温度下反应相同时间后,测得
和
的体积分数如下表:
|
温度/ |
950 |
1000 |
1050 |
1100 |
1150 |
|
|
0.5 |
1.5 |
3.6 |
5.5 |
8.5 |
|
|
0.0 |
0.0 |
0.1 |
0.4 |
1.8 |
请回答:
①反应Ⅲ能自发进行的条件是。
②下列说法正确的是。
A.其他条件不变时,用替代
作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,的转化率越高
C.由实验数据推出中的
键强于
中的
键
D.恒温恒压下,增加的体积分数,
的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图。

④在、常压下,保持通入的
体积分数不变,提高投料比
,
的转化率不变,原因是。
⑤在范围内(其他条件不变),
的体积分数随温度升高发生变化,写出该变化规律并分析原因。
Ⅰ.
Ⅱ.
①下列说法正确的是;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为
,
的物质的量为
。此时,整个体系(填“吸收”或“放出”)热量
,反应Ⅰ的平衡常数
(以分压表示,分压=总压×物质的量分数)。

①某温度下,吸收塔中 溶液吸收一定量的
后,
,则该溶液的
(该温度下
的
);
②再生塔中产生 的离子方程式为;
③利用电化学原理,将 电催化还原为
,阴极反应式为。

已知“降温收尘”后,粗 中含有的几种物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
136 |
127 |
57 |
180 |
回答下列问题:

|
物质 |
|
|
|
|
|
分压/ |
|
|
|
|
①该温度下, 与C、
反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。

已知:月桂酸 熔点为
;月桂酸和
均难溶于水。该工艺条件下,稀土离子保持
价不变;
的
;
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
| 离子 | | | | |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
②“操作X”的过程为:先,再固液分离。
①还原 和
熔融盐制备
时,生成
![]() 转移
转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
的还原,发生的电极反应为。
①完成化学方程式:
。
② 催化丙烷脱氢过程中,部分反应历程如图1,
过程的焓变为(列式表示)。

③ 可用于
的催化氧化。设计从
出发经过3步反应制备
的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
与
的比值保持不变
② 时,
溶液中
随pH的变化关系如图2。当
时,设
、
与
的平衡浓度分别为x、y、z
,则x、y、z之间的关系式为
;计算溶液中
的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长(
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、
不同的
稀溶液,测得其A随
的变化曲线如图3。波长
、
和
中,与
的
最接近的是;溶液
从a变到b的过程中,
的值(填“增大”“减小”或“不变”)。
①
②
③
计算热分解反应④
的
。

①越小,
平衡转化率,理由是。
②对应图中曲线,计算其在
之间,
分压的平均变化率为
。
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
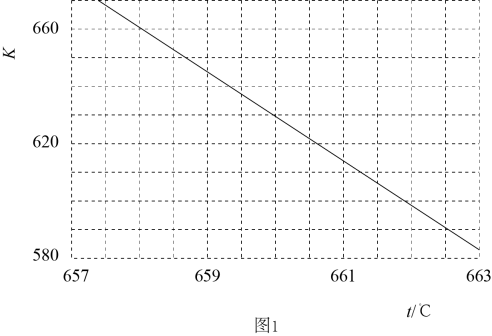
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
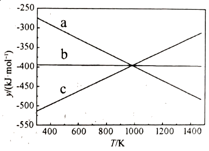
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
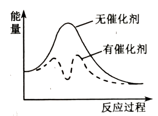
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。