
 B .
B .  C .
C .  D .
D . 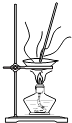 灼烧
B .
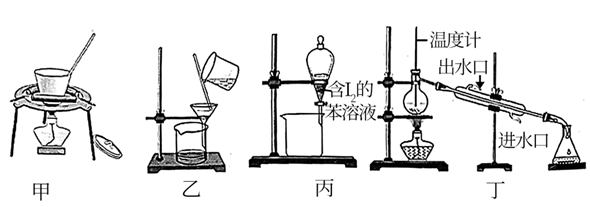
灼烧
B . 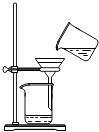 过滤
C .
过滤
C . 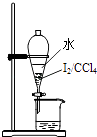 分液
D .
分液
D . 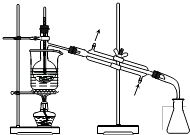 蒸馏
蒸馏
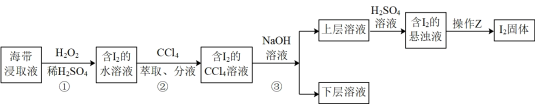
某化学活动小组在实验室中从海带灰浸取液获得纯碘实验方案如图所示,下列说法不正确的是( ) 



 B . 铝热反应
B . 铝热反应  C . 石油的分馏
C . 石油的分馏  D . 分离乙酸乙酯和水
D . 分离乙酸乙酯和水 


①碘44℃开始升华;
②溶剂的沸点
|
物质 |
四氯化碳 |
碘 |
甲醇 |
乙醚 |
丙酮 |
|
沸点℃ |
78 |
184.35 |
64.7 |
34.5 |
56.2 |
③2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
方案实施如下:甲同学取其中1份混合溶液用普通蒸馏装置进行蒸馏,使四氯化碳和碘分离,结果所得溶液显紫色。
乙同学认为甲同学的萃取剂选的不合适,于是重新取海带做实验,在萃取碘单质时,用其他试剂代替四氯化碳进行萃取分液,然后再蒸馏,结果得到无色溶液。
丙同学取其中1份混合溶液按下列过程进行实验。

丁同学取1份碘的四氯化碳溶液于锥形瓶中,用C molA,Na2S2O3溶液进行滴定,重复操作 2次,平均消耗Na2S2O3 V mL。
根据上述四位同学实验回答下列问题:
①过程A中混合液发生的离子反应方程式为。
②过程A操作是在盛有样品的分液漏斗中加入NaOH溶液,充分振荡,放气,静置分层,如图所示振荡和放气操作方法正确的是。

③过程B边加硫酸边振荡时,观察到有明显紫色蒸汽出现,原因是。继续加入硫酸,然后静置沉降,发现试管底部有较多紫黑色固体。说明碘离子已经全部转化的操作是。
①滴定终点的现象是。
②海带中碘含量为。

A.溶解 B.过滤 C.萃取 D.分液
从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如图装置完成。



已知:3I2+6NaOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
回答下列问题:
![]()
步骤①中,海水通过(操作名称)、趁热过滤,得到苦卤;步骤②选用作氧化剂,请写出发生反应的离子方程式。
将干海带经过浸泡、(操作名称),得到滤液

a.酒精b.苯c.四氯化碳d.醋酸
碘在该溶剂中显色

请填写下列空白:
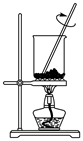
步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____(从下列仪器中选出所需的仪器,用标号字母填写在空自处)。

负极上发生的电极反应为。

步骤①灼烧海带时,除需要三脚架、泥三角、酒精灯外,还需要用到的实验仪器是____(填字母)。
A.酒精 B.醋酸 C.四氯化碳

已知:①的升华温度:45℃~77℃;②
沸点:76.8℃。回答下列问题:

A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为。
