 , 用pH试纸测试该物质的水溶液,试纸变红。请回答下列问题:
, 用pH试纸测试该物质的水溶液,试纸变红。请回答下列问题:

①写出反应②的化学方程式:。
②反应③的反应类型是。
③写出C与![]() 发生酯化反应的化学方程式为。
发生酯化反应的化学方程式为。
④下列关于![]() 的说法正确的是。
的说法正确的是。
A.可以使溴水和酸性高锰酸钾溶液褪色
B.能发生加聚反应形成高分子化合物
C.两分子相互反应可以形成环状结构的物质
D.能与碳酸钠溶液反应产生气体

下列各反应中,符合如图所示能量变化的是(填字母)。
a.盐酸与碳酸氢钠的反应 b.甲醇燃烧的反应
c.钠与水的反应 d.氢氧化钡与氯化铵的反应
能判断该反应达到化学平衡状态的标志有____
①0~5min,用表示的化学反应速率
。
②达到平衡后,下列措施中,不能使正反应速率增大的有(填标号)。
A.从平衡混合物中分离出甲醇
B.改用催化效率更高的催化剂
C.充入一定量的Ar
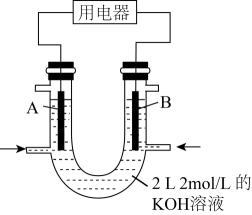
实验测得向B电极定向移动,则(填“A”或“B")处电极入口通甲醇,其电极反应式为。

某化学兴趣小组利用如图装置制备X并探究其相关性质。

A. B.
C.
D.
由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺……。下列做法不会危及人体健康的是____(填字母)。
下列各项属于“绿色化学”要求的是____(填字母)。

回答下列问题:
过程I采用的操作是。