 B .
B .  D .
D . 
 C .
C .  D .
D . 
 B .
B .  D .
D . 
装置 |
|
|
|
|
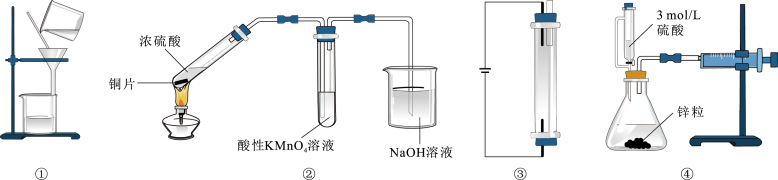
目的 | A.将海带灼烧成灰烬 | B.将Fe(OH)3胶体与FeCl3溶液分离 | C.验证碳酸氢钠受热易分解 | D.排掉碱式滴定管 胶管内的气泡 |
 C .
C .  D .
D . 
 B .
B .  D .
D . 

选项 | A | B | C | D |
装置 | 溴乙烷消去反应产生的气体
|
|
|
|
目的 | 验证溴乙烷消去产物具有还原性 | 制取并收集干燥的氨气 | 实验室焙烧硫酸铜晶体 | 实验室制取乙烯 |
 B .
B .  C .
C .  D .
D . 
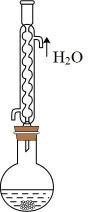

 C .
C . 



回答下列问题:
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用
标准溶液滴定
达终点时消耗
(滴定过程中
转化为
,
不反应)。
实验Ⅱ:另取样品,利用上述装置与足量
反应后,固体质量为
。
则;下列情况会导致n测量值偏小的是(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成

可选用试剂: 晶体、
溶液、浓
、稀
、
溶液、蒸馏水
步骤1. 的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
产品。

步骤2.产品中 的含量测定
①称取产品 ,用
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的 溶液;
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
。
回答下列问题:

已知:
苯胺 | 乙酸酐 | 冰醋酸 | 乙酰苯胺 |
沸点184℃,稍溶于水,易被氧化而变色。相对分子质量为93 | 沸点139℃,相对分子质量为102 | 沸点117.9℃,相对分子质量为60 | 无色晶体,沸点304℃,难溶于冷水,易溶于乙醇等有机溶剂。相对分子质量为135 |
(一)粗乙酰苯胺的制备
原理:
实验装置:如图一所示(夹持装置略)。

实验步骤:将35mL(38g)乙酸酐、37mL(39g)冰醋酸放入三颈烧瓶中,在B中放入25mL(25.5g)苯胺,逐滴滴加到三颈烧瓶中,边滴边振荡,滴加完毕小火加热30min。在搅拌下,趁热把反应混合物慢慢倒入500mL冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
(二)乙酰苯胺的提纯
①将粗乙酰苯胺晶体移入盛有500mL热水的烧杯中,加热至沸,使之溶解。
②稍冷后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为22.5g。
回答下列问题:

 )、对硝基苯酚(
)、对硝基苯酚( )是两种用途广泛的有机合成中间体,实验室可用苯酚(
)是两种用途广泛的有机合成中间体,实验室可用苯酚( )进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
)进行硝化制得。实验步骤和相关装置如下(其中夹持仪器和控温装置已省略):
I.在常温下,向装置①中的三口烧瓶中加入试剂:a.水;b.NaNO3;c.浓硫酸。
II.称取一定量苯酚,与少量温水混合,并冷却至室温。
III.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在15~ 20℃。
IV.加完苯酚后,继续搅拌1 h,冷却至黑色油状物固化,倾出酸层,然后用水洗涤数次。
V.邻硝基苯酚的收集:将油层利用装置②进行水蒸气蒸馏,得邻硝基苯酚粗品。
VI.对硝基苯酚的收集:在水蒸气蒸馏的残液中,加适量水,再加浓盐酸和少量活性炭,加热煮沸,趁热过滤,冷却结晶,分离得对硝基苯酚粗品。
已知:邻硝基苯酚、对硝基苯酚室温下在水中溶解度较小,邻硝基苯酚能与水蒸气一同挥发。
A. acb B. cab C. cba
实验中生成NaHSO4 , 写出得到邻硝基苯酚的化学方程式:。

已知:(NH4)2S2O8具有强氧化性,不稳定易分解。
回答下列问题:
 B .
B . 

①与普通过滤相比,抽滤的优点为。
②抽滤完毕后,应先断开之间的橡皮管。
①微热目的是
②滴定终点现象是
③滤液B中c(Cr3+)=

物质的相关性质如下表:
物质 | SO3 | SCl2 | SOCl2 |
熔点/℃ | 16.8 | -78 | -105 |
沸点/℃ | 44.8 | 60 | 78.8 |
与水反应 | 均能与水剧烈反应 | ||
已知:H2SO4(浓)SO3+H2O;SCl2与SOCl2互溶。
实验步骤如下:
①通入干燥的氮气(能够抑制三氧化硫气体逸出),观察A中气泡控制N2的流速;
②将P2O5固体置于烧瓶B中,向B中分多次缓慢加入5.44mL浓硫酸(密度为1.84g· cm-3 , 质量分数为98%),再向C中加入足量SCl2;
③冷凝管接入冷凝水后将烧瓶B升温至225℃,三氧化硫液体缓慢流入锥形瓶C中;
④反应完成后取下锥形瓶C,……(操作),得到高纯SOCl2产物。
回答下列问题:
3![]() +Na2Cr2O7+4H2SO4→3
+Na2Cr2O7+4H2SO4→3![]() +Cr2(SO4)3+Na2SO4+7H2O
+Cr2(SO4)3+Na2SO4+7H2O
主要反应试剂及物理常数:
名称 | 相对分子质量 | 沸点(℃) | 溶解度 | ||
水 | 乙醇 | 乙醚 | |||
环己醇 | 100 | 160.9 | 可溶 | 可溶 | 可溶 |
环己酮 | 98 | 155.7 | 易溶 | 易溶 | 微溶 |
已知:环己酮可被铬酸进一步氧化。回答下列问题:

完成下列填空:
画出乙中实验装置图,并标出相应试剂。
写出侯氏制碱法中生成NaHCO3的离子方程式。操作时,往饱和食盐水中先通入气体,原因是。

第一步:检验左侧A、B、C、D四个装置的气密性:
①在D中加水没过干燥管下端,打开K1 ,
②关闭。
③微热A装置
④若,则气密性良好。
第二步:同理检查右侧装置E和F的气密性
探究Ⅰ:SO2的氧化性和还原性
打开K1 , 关闭K2 , 然后向三颈烧瓶中加入适量浓硫酸,加热装置A一段时间后,观察现象。
探究Ⅱ:进一步探究SO2的还原性
物理量 实验序号 | 反应温度 (℃) | 0.1 mol/LNa2S2O3溶液体积(mL) | 0.1 mol/L H2SO4溶液 体积(mL) | 出现浑浊所用的时间(min) |
1 | a | c | c | e |
2 | a | d | c | f |
3 | b | c | V1 | g |
………… |
① V1=
②有同学认为1和2两组对照实验不能完成探究浓度对Na2S2O3溶液和稀H2SO4反应速率的影响,请设计简单的实验方法进行改进。

请回答下列问题:
①滴定终点的现象是。
②则NaC3N3O3Cl2的百分含量为%。(用含m,c,V的代数式表示)