
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是( )

已知:(NH4)2S2O8具有强氧化性,不稳定易分解。
回答下列问题:
 B .
B . 

①与普通过滤相比,抽滤的优点为。
②抽滤完毕后,应先断开之间的橡皮管。
①微热目的是
②滴定终点现象是
③滤液B中c(Cr3+)=

已知:①氧化时鼓入空气使溶液的电位迅速上升;
②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。
回答下列问题:


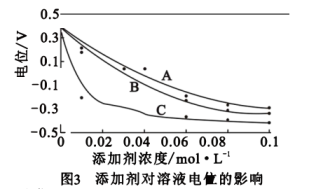
氧化时N2H4·H2O的作用是
①热还原法
在甲烷气体存在下,将Mn2O3还原成Mn3O4的化学方程式为
②电解法:
利用电解原理,制备四氧化三锰装置如图所示。(电极材料均为惰性电极,<代表电子流向)
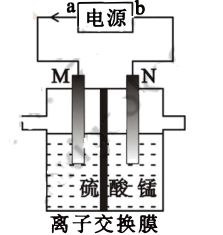
电源正极为(填“a”或“b”),阳极的电极反应式为
|
化合物 |
CO2(g) |
CH3OH(g) |
H2O(g) |
|
摩尔生成焓/(kJ·mol-1) |
-395 |
-200 |
-242 |
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
①反应Ⅰ的焓变△H1=kJ·mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2 , 起始及达平衡时,容器内各气体物质的量如表所示。
|
|
CO2 |
H2 |
CH3OH |
CO |
H2O |
|
起始量/mol |
4.0 |
8.0 |
0 |
0 |
0 |
|
平衡量/mol |
n1 |
3.0 |
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=,反应I的平衡常数Kp=。(无需带单位,用含p的式子表示)。
|
实验序号 |
温度(K) |
不同工程酶的组块 |
淀粉(g/L) |
|
1 |
T1 |
无 |
0.21 |
|
2 |
T1 |
agp-M1 |
0.38 |
|
3 |
T2 |
agp-M2 |
1.82 |
|
4 |
T2 |
agp-M3 |
1.24 |
①最佳的反应条件为
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能的原因是。
③实验4可用淀粉的质量浓度表示反应速率为g·L-1·h-1 , 淀粉的产率为(用含a的代数式表示)。
卤化磷 | 熔点/K | 沸点/K |
PF3 | 121.5 | 171.5 |
PCl3 | 161 | 348.5 |
PBr3 | 233 | 451.2 |
PI3 | 334 | 573 |


已知以下信息:
a)TBSCl为叔丁基二甲基氯硅烷,分子式(CH3)3CSi(CH3)2Cl
b)HO-(CH2)4-OHHO-CH2CH2CH2CHO
c)
![]()
回答下列问题:
①苯环上只有一种氢
②苯环上只有两种不同的取代基
③1mol该物质发生银镜反应,最多可生成6molAg
 为原料合成
为原料合成 的路线(其他试剂任选)
的路线(其他试剂任选)