
元素代号 | M | N | O | P | Q |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.071 |
主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -1 |


已知:①气体体积均在标况下测定、无色气体D是一种单质;②反应均完全发生。
下列说法正确的是






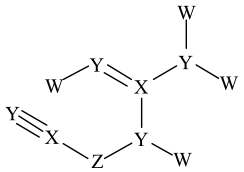

X | Y | |
Z | W |

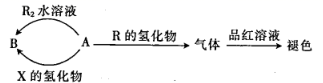



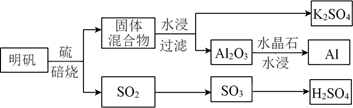
焙烧明矾的化学方程式为。
|
第一电离能 |
离子半径 |
熔点 |
酸性 |
|
OS |
Cl-K+ |
KClAl2O3 |
H2SO4HClO4 |

回答下列问题:
①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。

①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。

①碳在元素周期表中的位置是。
②整个过程中FeO的作用是。
③写出CO2转化为炭黑的总反应化学方程式。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是。

①写出阴极CO2还原为HCOO−的电极反应式:。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是。

A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
|
GaN |
GaP |
GaAs |
|
|
熔点 |
1700℃ |
1480℃ |
1238℃ |
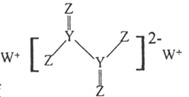
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为;
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为 ![]() a3cm3 , GaN晶体的密度为g/cm3(用a、NA表示)。
a3cm3 , GaN晶体的密度为g/cm3(用a、NA表示)。

图1 图2
