①扩大容器的容积②使用催化剂③增加反应物的质量④升高温度⑤缩小容积.
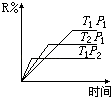
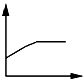 B .
B . 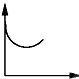 C .
C . 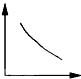 D .
D . 
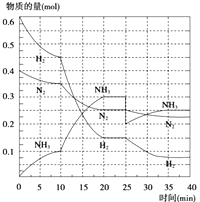
①10min内以NH3表示的平均反应速率:.
②在10~20min内:NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次平衡的时间为:,第2次平衡的时间为:,第1次平衡:平衡常数K1=(带数据的表达式),第2次平衡时NH3的体积分数;
④在反应进行至25min时,曲线发生变化的原因:,
达第二次平衡时,新平衡的平衡常数K2K1 , (填“大于”、“小于”或“等于”).
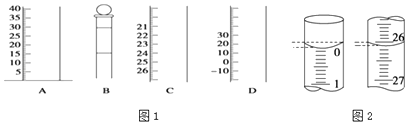
①写出仪器名称BC
②使用前需检查是否漏水的仪器有.
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度.(保留两位有效数字)