工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
写出以赤铁矿为原料,在高温下炼铁的化学方程式:;
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
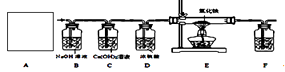
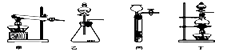
图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的(填装置编号);
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;② ③ 。
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:。