N2(g)+ O2(g)= 2NO(g) ΔH= b kJ·mol -1
H2O(l)= H2O(g) ΔH= c kJ·mol -1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l) 的反应热ΔH=。
以下说法正确的是 。
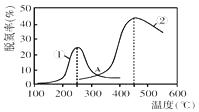
在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如下图所示。
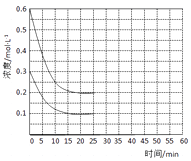
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2 , 则此时v(正)v(逆)(填>、<或=)。判断的理由是。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和 1molCO2 , 在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。
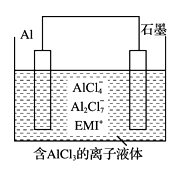
该电池放电时的负极反应方程式为