i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2= SO42-+4H++2 I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | I | II | III | IV |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
⑴向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀;
⑵将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是( )
N2(g)+ O2(g)= 2NO(g) ΔH= b kJ·mol -1
H2O(l)= H2O(g) ΔH= c kJ·mol -1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l) 的反应热ΔH=。
以下说法正确的是 。
在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如下图所示。
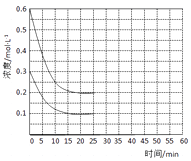
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2 , 则此时v(正)v(逆)(填>、<或=)。判断的理由是。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和 1molCO2 , 在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。
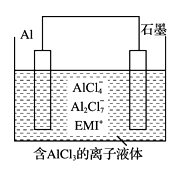
该电池放电时的负极反应方程式为
实验步骤:
(I)碱式碳酸铜的制备
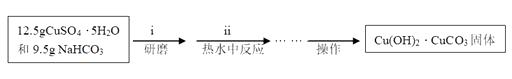
(II)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2∙CuCO3+4CH3COOH=2(CH3COO)2Cu∙H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的1/3左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu∙H2O产品,称量,计算产率。
回答下列问题:
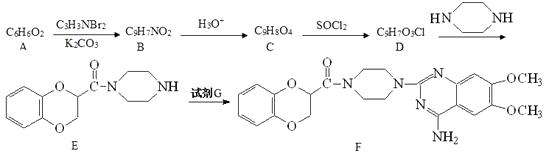
已知:① ![]()
② ![]()
请回答:

①与FeCl3溶液能显紫色
②1H—NMR谱显示分子中有4种氢原子;IR谱表明分子中有C=C与C≡N