反应原理为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O=2I-+S4O
步骤如下:
步骤①称取20.000g市售食盐,在容量瓶中配制成100mL溶液;
步骤②取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液。
步骤③向锥形瓶中滴加指示剂,用Na2S2O3溶液滴定步骤②所得溶液。平行滴定3次。
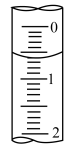
选出正确操作并排序检查是否漏水→蒸馏水洗涤→→→a→→→。
a.加液至“0”刻度以上2~3mL处
b.调整液面至“0”刻度或“0”刻度下方,记录读数V₁
c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加3~5mLNa2S2O3标准液
f.向酸式滴定管中加3~5mLNa2S2O3标准液
g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)