已知:反应Ⅰ.2NO(g)+O2(g) 2NO2(g)
-112 kJ·mol-1;
反应Ⅱ.2NO2(g) N2O4(g)
-24.2 kJ·mol-1;
反应Ⅲ.3O2(g) 2O3(g)
+144.6 kJ·mol-1;
②平衡时O2的转化率α(O2)30%(填“>”“=”或“<”)。
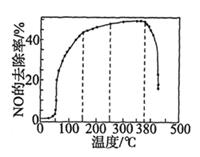
②一定温度下,按进料比n(NH3):n(NO) =1:1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380℃时,NO的去除率迅速下降的原因可能是。