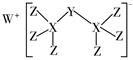
|
选项 |
实验 |
现象 |
结论 |
|
A |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将Fe氧化为Fe3+ |
|
B |
将铜粉加入1.0mol·L-1 Fe2(SO4)3溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
|
C |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
|
D |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1 CuSO4溶液 |
先有白色沉淀生成,后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比 Mg(OH)2的小 |
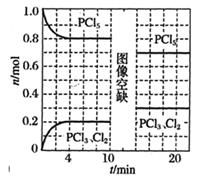
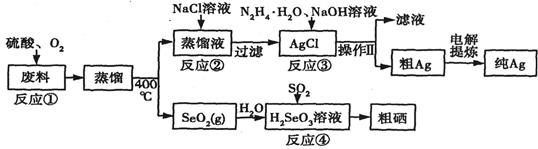
回答下列问题:
已知:反应Ⅰ.2NO(g)+O2(g) 2NO2(g)
-112 kJ·mol-1;
反应Ⅱ.2NO2(g) N2O4(g)
-24.2 kJ·mol-1;
反应Ⅲ.3O2(g) 2O3(g)
+144.6 kJ·mol-1;
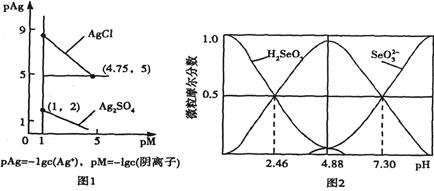
②平衡时O2的转化率α(O2)30%(填“>”“=”或“<”)。
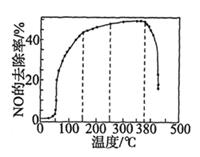
②一定温度下,按进料比n(NH3):n(NO) =1:1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380℃时,NO的去除率迅速下降的原因可能是。
Cu(Inl-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
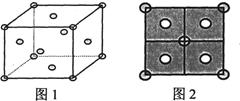
①CuS晶体中,相邻的两个铜离子间的距离为pm。
②Cu2S晶体中,S2-的配位数为。
⑨Cu2S晶体的密度为p=g·cm-3(列出计算式即可)。