1.
(2017·武昌模拟)
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
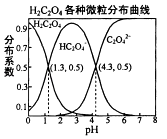
A . HC2O4﹣⇌H++C2O42﹣ , K=1×10﹣4.3
B . 将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C . 常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D . 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
