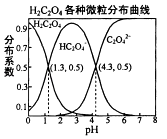
已知:碳酸锂的溶解度为((g/L)
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
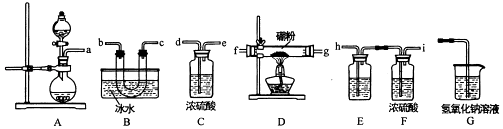
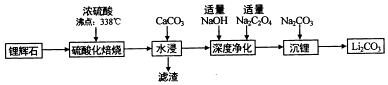
【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl 2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为.
2NO(g)+2CO(g)⇌N2(g)+2CO2 (g)△H
已知:
①N2(g)+O2(g)⇌2NO(g)△H1=+180.5kJ•mol﹣1
②2CO(g)⇌2C(s)+O2(g)△H2=+221kJ•mol﹣1
③C(s)+O2(g)⇌CO2(g)△H3=﹣393.5kJ•mol﹣1
则△H=
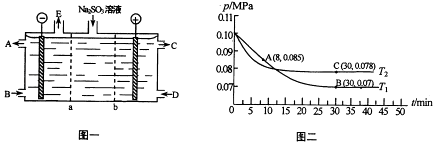
①a表示离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示.E表示.
②阳极的电极反应式为.
反应为:2SO2(g)+O2(g)⇌2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强与反应时间如图二所示.
①图中A点时,SO2的转化率为.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,刻C点的正反应
速率vc(正)与A点的逆反应速率vc (逆)的大小关系为vc(正) vc (逆) (填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).