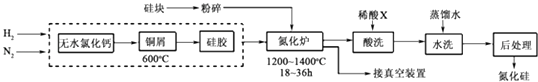
①净化N2和H2时,铜屑的作用是:;硅胶的作用是.
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了.
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
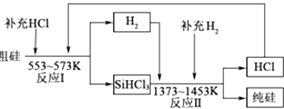
①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式.
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是.