离子方程式 | 评价 | |
A | Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3﹣+2OH﹣═MgCO3↓+CO32﹣+2H2O | 正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
B | 1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O | 正确,AlO2﹣与H+按物质的量1:1反应转化为Al(OH)3 , 过量的H+再将一半Al(OH)3转化为Al3+ |
C | 将少量的Fe3O4溶解在过量的稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O | 正确,Fe3O4化学式可改写为FeO•Fe2O3 , Fe2+与Fe3+物质的量之比为1:2 |
D | 将FeCl2溶液加入到NaClO溶液中:Fe2++2ClO﹣+2H2O═Fe(OH)2↓+2HClO | 错误,Fe2+与ClO﹣会发生氧化还原反应: 2Fe2++ClO﹣+5H2O═2Fe(OH)3↓+Cl﹣+4H+ |
请回答下列问题:
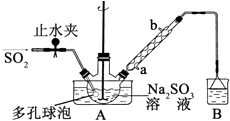
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2 , 至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
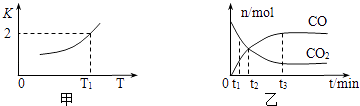
①该反应的逆反应是(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
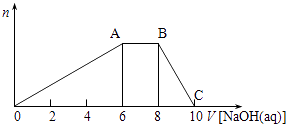
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2 , 反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为,平衡时混合气体的密度与起始时气体的密度之比为.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
起始时乙容器中的压强是甲容器的倍.
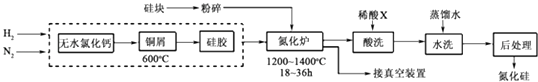
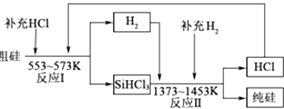
①净化N2和H2时,铜屑的作用是:;硅胶的作用是.
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了.
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式.
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是.