压强/(×105 Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是( )
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。
下列说法不正确的是( )
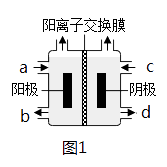
收集到(CH3)4NOH的区域是(填a、b、c或d)。
CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·molˉ1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·molˉ1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
请完成:
关于该反应,下列说法不合理的是________。

2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
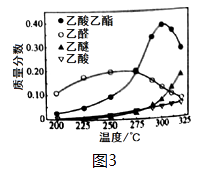
在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
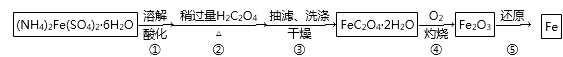
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:

a.转移固液混合物; b.关活塞A;
c.开活塞A; d.确认抽干; e.加洗涤剂洗涤
n(Fe2+)/mol | n(C2O)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是。

已知: 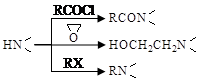
请回答:
须同时符合:①分子中有一个六元环,且成环原子中最多含一个非碳原子;
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。