试管 | 温度 | 过氧化氢浓度 | 催化剂 |
A | 室温(25℃) | 12% | 有 |
B | 水浴加热(50℃) | 4% | 无 |
C | 水浴加热( 50℃) | 12% | 有 |
D | 室温(25℃) | 4% | 无 |
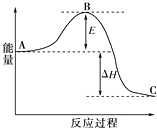
①图中E的大小对该反应热有无影响?.该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?,理由.
②图中△H=kJ/mol.
③如果反应速率v(H2)为0.15mol/(L•min),则v(N2)=mol/(L•min),v(NH3)=.
已知:N2(g)+2O2(g)=N2O4(l)?△H=﹣19.5kJ•mol﹣1
N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=﹣534.2kJ•mol﹣1
请写出肼和 N2O4反应的热化学反应方程式.