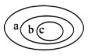
选项 | a | b | C |
A | 原子 | 原子核 | 质子 |
B | 单质 | 化合物 | 臭氧 |
C | 金属 | 非金属 | 汞 |
D | 纯净物 | 混合物 | 冰水混合物 |
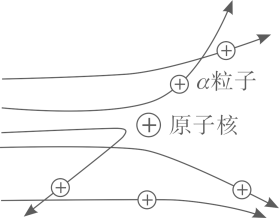
现象 1:大多数α粒子能穿透金箔而不改变原来的运动方向。
现象 2:一小部分α粒子改变原来的运动方向。
现象 3:极少数α粒子被弹了回来。
a.科学模型的建立是一个不断完善、不断修正的过程
b.模型在科学研究中起着很重要的作用
c.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
d.人类借助模型的建立,对原子的认识逐渐接近本质
①1897年,汤姆生通过实验发现了,进一步发展了原子论、分子论。汤姆生主要是纠正了“道尔顿原子论”中的观点。②1911年,卢瑟福又通过实验,推测原子是由构成的,并提出了沿用至今的现代原子结构理论。③道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的。