
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物 。下列说法错误的是( )
| 实验操作 | 实验现象或结论 | |
| A | 向2支均盛有2mL1.0mol•L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol•L-1的AlCl3和MgCl2溶液,加入MgCl2溶液的试管出现白色沉淀,另一支无明显现象 | Ksp [Al(OH)3]>Ksp[Mg(OH)2] |
| B | 向盛有KI溶液的试管中滴加氯水和CCl4液体,振荡 | 下层溶液变为紫红色 |
| C | 室温下,用pH试纸分别测0.1mol•L-1Na2SO3和0.1mol•L-1Na2CO3溶液的pH | Na2SO3溶液的pH约为10,Na2CO3溶液的pH约为12,则说明CO32-水解的能力比SO32-的强 |
| D | 向盛有Na2S2O3溶液的试管中先滴入酚酞溶液,然后滴加盐酸,边滴边振荡 | 溶液先变红后褪色,有气泡产生并出现浑浊 |
 分离CH3COOH和CH3COOC2H5混合液
B .
分离CH3COOH和CH3COOC2H5混合液
B .  验证NH4NO3晶体溶于水的热效应
C .
验证NH4NO3晶体溶于水的热效应
C .  蒸发FeCl3溶液得到FeCl3固体
D .
蒸发FeCl3溶液得到FeCl3固体
D .  验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三角架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入混合液液面以下 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法错误的是( )
|
实验目的 |
实验操作 |
|
|
A |
用18.4mol·L-1的浓硫酸配制100mL1.84mol·L-1的稀硫酸 |
用量筒量取10.0mL浓硫酸后,需用水洗涤量筒,并将洗涤液液转入容量瓶 |
|
B |
用酸性高锰酸钾溶液测定溶液中Fe2+的浓度 |
将酸性高锰酸钾溶液装入碱性滴定管中进行滴定 |
|
C |
分离苯萃取溴水中的水层和有机层 |
将分液漏斗下面的话塞拧开,放出水层,再换一个烧杯放出有机层 |
|
D |
除去乙醇中的水 |
加入生石灰,进行蒸馏 |
| 物质 | Br2 | CCl4 | 乙苯 |
| 密度(g/cm3) | 3.12 | 1.60 | 0.87 |
| 沸点(℃) | 58.8 | 76.8 | 136.2 |
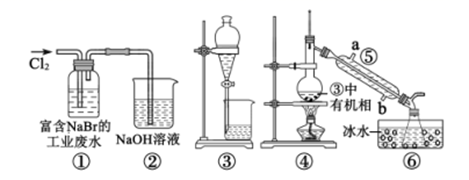
下列说法错误的是( )
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
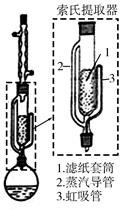
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯


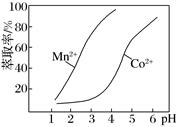
下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
| Al3+ | Fe3+ | Fe2+ | Mn2+ | Co2+ | |
| 开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.7 | 7.6 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.6 | 9.8 | 9.2 |
请补充完整由“氧化”后的溶液制备CoCO3的实验方案:向“氧化”后的溶液中加入,得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。

已知:
①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+2等
②部分阳离子开始沉淀和完全沉淀的pH见下表

③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。

A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5

![]()
①“残渣2”中Cr元素的质量分数为(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会是(填“偏高”、“偏低”或“无影响”),其原因是。

已知: 氧化铝有两种晶型α-Al2O3 和γ- Al2O3 , α- Al2O3致密难溶于酸和碱。


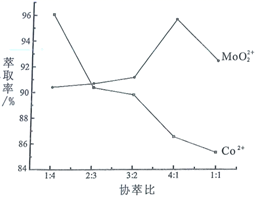
萃取分离钴、铝的实验操作为: 向萃取分液后的有机相中加硫酸调pH=3~4,分液可得CoSO4溶液,,可得Al2(SO4)3溶液。
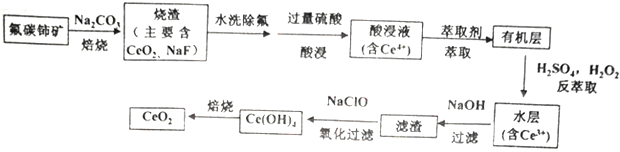
已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
①实验室中萃取时用到的主要玻璃仪器为烧杯和。
②如图,D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( ![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。
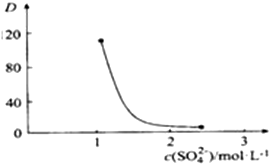
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2 , 充分振荡,静置,水层中c(CeSO42+)=。 (结果保留三位有效数字)
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层﹣﹣含低浓度I2的H2SO4层和高浓度的I2的HI层.
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
反应Ⅱ:2H2SO4(l)→2SO2(g)+O2(g)+2H2O(g)﹣1100kJ 它由两步反应组成:
i.H2SO4(l)→SO3(g)+H2O(g)﹣177kJ ii.SO3(g)分解.
L(L1、L2),X可分别代表压强或温度.图2表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系.

①收集环己烯粗产品时温度计的温度为℃左右;
②烧瓶中主反应的化学方程式为。
②饱和食盐水的主要作用是降低环己烯的溶解度和。
①写出环己烯与的化学反应方程式。
②样品中环己烯的质量分数为。
③下列情况会导致测定结果偏高的是(填字母)。
a.样品中含有苯酚杂质
b.标准溶液部分被氧化
c.在测定过程中部分环己烯挥发
 )是一种常用镇痛药,难溶于水,易溶于醇、醚类。实验室里可由对氨基苯甲酸(
)是一种常用镇痛药,难溶于水,易溶于醇、醚类。实验室里可由对氨基苯甲酸( )与乙醇反应合成。
)与乙醇反应合成。 已知:几种物质的某些数据如下。
|
试剂 |
相对分子质量 |
密度/g·cm-3 |
熔点/℃ |
沸点/℃ |
|
乙醇 |
46 |
0.79 |
78.5 |
|
|
对氨基苯甲酸 |
137 |
188 |
399.9 |
|
|
对氨基萃甲酸乙酯 |
165 |
90 |
172 |
|
|
乙醚 |
74 |
0.714 |
34.5 |
回答下列问题:

对氨基苯甲酸在一定条件下可生成高分子化合物,该反应的化学方程式为。
①在圆底烧瓶中加入5.48g对氨基苯甲酸和60mL无水乙醇,振荡溶解,再加入8mL浓硫酸,将反应混合物在80℃水浴中加热1h,并不时振荡;
②液体冷却后将反应物转移到烧杯中,分批加入Na2CO3溶液(10%)至pH=9;
③将液体转移至分液漏斗中,用乙醚分两次萃取;
④向乙醚层加入无水硫酸镁,滤去固体,进行操作a,冷却结晶,最终得到2.48g产物。
仪器A的名称为,作用是。

A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出

a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
