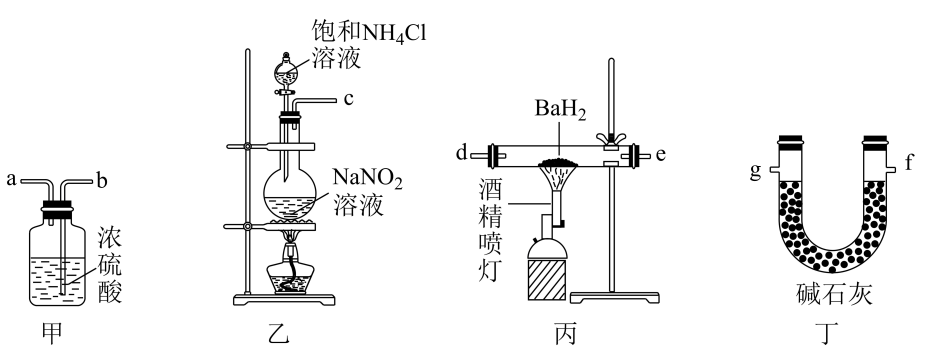







已知:①无水四氯化锡的熔点-33℃、沸点114.1℃;②四氯化锡易水解,易溶于有机溶剂。下列说法正确的是( )
为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
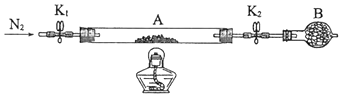
①仪器B的名称是.
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
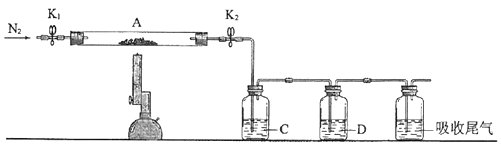
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为.
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式.

下列有关说法正确的是____(填标号)。
|
实验 |
操作与现象 |
结论 |
|
Ⅰ |
取少量 |
样品中含 |
|
Ⅱ |
向实验Ⅰ的溶液中滴加 |
样品中含 |
①由实验Ⅱ知,样品中还含有(填化学式),产生该杂质的可能原因是(填标号)。
A.通入的氢气过量 B.未反应完 C.温度过高
②测定产品纯度:向wg样品(设杂质只有)中加入过量的
稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准
的NaOH溶液滴定过量的硫酸,消耗NaOH溶液
。
样品的纯度为(列出计算式)。

干燥的NH3可选用以下装置制得,相应的连接顺序可以是→→(选填端口字母编号)。

无水氯化铬具有很强的吸水性,通常形成晶体CrCl3·6H2O。直接加热脱水往往得到Cr2O3 , 有关反应的化学方程式为。以氯化铬晶体制备无水氯化铬的方法是。
写出NH3与Cr2O3发生氧化还原反应的化学方程式:。

物质 | 性质 |
SiCl4 | 无色油状液体,能剧烈水解生成硅酸和HCl |
乙酸酐[(CH3CO)2O] | 无色油状液体,吸湿性很强 |
四乙酸硅[Si(CH3COO)4] | 米黄色晶体,可溶于苯,遇水会迅速水解,超过160℃时可分解成乙酸酐和二氧化硅 |
乙酰氯(CH3COCl) | 无色油状液体,遇水剧烈反应 |
回答下列问题:
实验步骤:
I.K2MnO4制备:称取7.0gKOH和5.0gKClO3于铁坩锅中混匀,固定坩埚,小火加热,用铁棒搅拌,待混合物熔融,边搅拌边逐渐加入MnO2 , 可见熔融物黏度增大,不断用力搅拌,以防结块。待反应物快干时,不断搅拌使其呈颗粒状,加大火焰,强热6分钟,即得墨绿色的K2MnO4。
II.K2MnO4浸取:待物料冷却,于研钵中研细,在烧杯中用40mL蒸馏水浸取,搅拌、加热,静置,分离出上层清液于另一个烧杯中,依次用20mL蒸馏水、20mL4.0%KOH溶液重复浸取,合并三次浸取液。
III.K2MnO4歧化:向浸取液中通入CO2气体,溶液逐渐变色,用pH试纸测试溶液,当pH达到10~11时,停止通气,加热溶液,趁热抽滤。
IV.KMnO4结晶:将滤液蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,得到产品。
合成反应:3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O,3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3。
有关物质的溶解度(g/100g水):
|
|
0℃ |
10℃ |
20℃ |
30℃ |
| K2CO3 |
105 |
109 |
111 |
114 |
| KHCO3 |
22.5 |
27.4 |
33.7 |
39.9 |
请回答:

a.打开活塞;b.关闭活塞;c.确认抽干;d.用冷水洗涤;e.用无水乙醇洗涤;f.调低抽气泵真空度(减缓抽滤速度)。
……
①移取一定量KMnO4溶液可选用移液管或(填“酸式”或“碱式”)滴定管。
②滴定时无需另外加入指示剂,滴定终点的现象为。
③若产品中混有少量K2CO3杂质,则滴定结果(填“偏高”“偏低”或“无影响”)。
 请回答:
请回答:
①小火加热,蒸发至有较多晶体析出,停止加热 ②小火加热,边加热边用玻璃棒不断搅拌 ③迅速降至室温 ④自然冷却至室温 ⑤当浓缩至液面出现晶膜时,停止加热 ⑥将步骤Ⅲ的滤液移至蒸发皿内
准确称取基准物置于锥形瓶中,加水溶解,再加适量
的硫酸。将自制的高锰酸钾配成溶液,置于棕色滴定管中进行滴定。
①已知:转化为
, 写出滴定时的离子方程式:。
②滴定时,到达终点的实验现象是。
③滴定终点示意图如图,则下列读数合理的是。

A. B.
C.
D.

试回答下列问题:
将MnO2固体与KOH固体混合加热熔融得到K2MnO4 , 化学方程式是。
A. ![]() B.
B. ![]() C.
C.  D.
D.  E.
E. ![]()
已知:K2MnO4在酸性或者中性的水溶液中易歧化

A中使用油浴加热的优点是。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:⑴硫酸铜晶体易溶于水,难溶于乙醇。
⑵硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
①使晶体从溶液中析出,可采取的方式有(写出两条)。
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序→→→f→。
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是。
④若测得结晶水的含量偏低,则杂质可能是。
II.采用金属铜单质制备硫酸铜晶体

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为。
已知: 。请回答:

①实验开始时先通气体,再通冷凝水
②控制气流速率,不宜过快
③可给三颈烧瓶适当降温
已知:i._ Na2SO3+_ NCl3 +_=_Na2SO4 +_ HCl+ _NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:
②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。
![]()
已知:①I2(s)+I-(aq) I
(aq)。
②水合肼(N2H4•H2O)具有强还原性,可将各种价态的碘还原为I- , 氧化产物为N2。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
①采用的加热方式为。
②I2与Na2CO3溶液同时发生两个反应,生成物除NaI外,还分别生成NaIO和NaIO3 , 一个反应为:I2+Na2CO3=NaI+NaIO+CO2↑,另一个反应为:。
③I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因是。
①向步骤Ⅱ得到的溶液中加入稍过量Ba(OH)2溶液,过滤,得到溶液A;
②在溶液A中加入过量试剂X,过滤,得溶液B;
③在溶液B中加入试剂Y,将溶液的pH调整至6.5~7,得粗NaI溶液。
则:试剂X的化学式为,试剂Y的化学式为。

①减压蒸发结晶②真空干燥③NaI•2H2O粗品溶解④趁热过滤
I.实验室制备亚硝酸钠
某化学兴趣小组设计如下实验装置(略去夹持仪器)制各亚硝酸钠。
已知:①2NO+Na2O2=2NaNO2 , ②酸性条件下,NO、NO2或 都能与
反应生成
和Mn2+。
回答下列问题:

实验装置如图:

请回答下列问题:

已知:“沉淀”时需控制温度在0℃左右; 为白色晶体,微溶于水,不溶于乙醇等有机溶剂,加热至366℃时开始分解放出氧气。

①“沉淀”装置连接顺序为(填接口序号)。
②橡胶管X的作用是。
③B中反应需在冰水浴中进行,除了便于析出晶体外,另一个原因是。
④B中反应的离子方程式为。
②洗涤 ,最佳试剂是(填序号)。
A.水 B.无水乙醇

实验中用恒压滴液漏斗,相比普通分液漏斗,其显著优点是。
已知:①NO+NO2+2OH-=2NO +H2O ②气体液化的温度:NO2:21℃,NO:-152℃
反应前应打开弹簧夹,先通入一段时间氮气,其目的是。

①确认A中产生的气体含有NO,依据的现象是。
②装置E的作用是。
③通过上述实验探究过程,可得出装置A中反应的化学方程式为。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:。
实验原理:
已知:① 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
② 沸点为57.6℃;
③在碱性条件下, 能把
氧化为
;
在酸性条件下, 能把
还原为
。
回答下列问题:
利用工业氮气(混有 、
、
)制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→。

实验装置如图2所示(加热、夹持等装置已略去)。

通入 的作用是(写出2点)。
a.称取
产品,在强碱性条件下,加入过量的30%
溶液,小火加热使
完全转化为
,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓 和浓
,使
转化为
;
c.用新配制的 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:
),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
①上述操作a中“继续加热一段时间”的目的是。
②加浓 的目的是为了防止指示剂提前变色。若不加浓
,则测得的
的质量分数将(填“偏低”、“偏高”或“不变”)。
③产品中 的质量分数为%(保留一位小数)。

回答下列问题:

①氧气的发生装置可以选择上图中的(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→(填小写字母);检验氧气已收集满的操作和现象为。

①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2 , 打开K1 , 旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
|
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | ||

①H2还原无水FeCl3制取FeCl2的化学方程式为。
②按气流由左到右的方向,上述仪器的连接顺序为(填字母,装置可多次使用);C中盛放的试剂是。
③该制备装置的缺点为。

①仪器a的名称是。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是,回收滤液中C6H5Cl的操作方法是。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:(写出一点即可)。
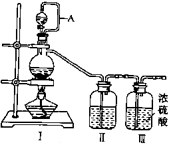
①写出利用装置Ⅰ制备氯气的离子反应方程式:。
② 利用上述装置制备NO时,Ⅱ中盛装物质为(写化学式)。

①装置连接顺序为a→按气流自左向右方向,用小写字母表示)。
②为使NO和Cl2恰好完全反应生成CNO,理论上通入NO和Cl2 , 两种气体的流速比为。
③装置Ⅸ的作用是。
④装置吸收尾气,有同学认为尾气中的某种气体不能完金被吸收。为了充分吸收尾气,可将尾气与(气体)同时通入NaON溶液中。
⑤王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2 , 该反应的化学方程式为。
⑥写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中,。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:

开抽气泵→a→b→d→→c→关抽气泵。
a.转移固液混合物;b.关活塞A;c.开活塞A;d.确认抽干;e.加洗涤剂洗涤
抽滤和普通过滤相比,优点是。
采用KMnO4滴定法测定,折算结果如下:
|
n(Fe2+)/mol |
n( | 试样中FeC2O4·2H2O的质量分数 |
| 9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是。
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);
该步骤的化学方程式是。