


步骤1:先将该气体通入品红溶液中,观察现象;
步骤2:将步骤1中的气体通入酸性高锰酸钾溶液后再通过品红溶液,观察现象;
步骤3:再将步骤2中的气体通入澄清石灰水中,观察现象。
下列说法错误的是( )
 , 该合金化学式是FeC
, 该合金化学式是FeC
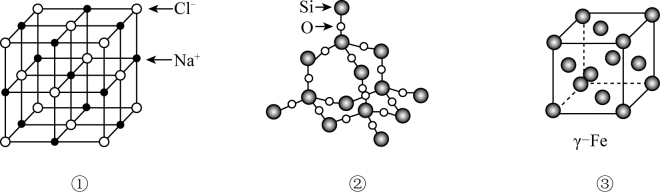
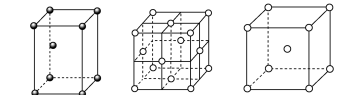



锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
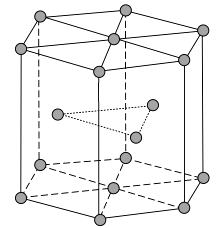


①该化合物的化学式为,已知晶胞参数a=0.542 nm,此晶体的密度为g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为。
