已知:废铁屑主要为表面附有大量铁锈的铁;
Fe(OH)3难溶于水,加热时会分解生成氧化铁和水;
流程图中反应Ⅱ加入H2O2溶液的目的是将滤液I中的FeSO4氧化成Fe2(SO4)3 。

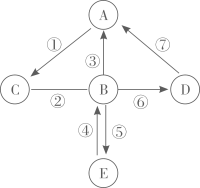
Ⅰ.反应②的化学方程式为。
Ⅱ.下列说法中不正确的是(填数字序号)
①A和B都可以用于灭火
②C可以用于改良酸性土壤和治疗胃酸过多
③B和D在一定条件下可以相互转化
④D的类别可以是单质、酸、盐、有机物
【查阅资料】①Fe2O3•xH2O失去结晶水温度为110℃ ;
②温度高于500℃时铁的氧化物才能被CO还原;
③碱石灰的成分是NaOH和CaO。
【设计实验】兴趣小组在科研人员的指导下设计了如下实验方案供大家讨论。
(已知: H2C2O4(草酸) CO↑+CO2↑+H2O )
先将D装置温度控制在200℃充分加热至质量不变,再将温度升高到500℃以上的高温,继续加热。

a. 浓硫酸、氢氧化钠溶液 b.氢氧化钠溶液、浓硫酸
开始进行上述实验时,应先点燃A装置中的酒精灯,一会儿后对D玻璃管加热,原因是 。
称取一定量此铁锈样品,实验结束,冷却后称量,装置E增重5.4g,装置F增重13.2g。则样品中Fe2O3•xH2O中x=
有同学认为该装置有缺陷,你认为“缺陷”是