称取NaNO2固体样品(杂质不与酸性KMnO4溶液反应)4.000 g溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
第一组实验数据出现异常,造成这种异常的原因可能是____( (填字母)。
反应后溶液中存在的硝酸根,可以采用电化学降解法进行处理。25℃时,反应进行10 min,溶液的pH由7变为12,电化学降解的原理如图所示。
电源正极为(填A或B),阴极反应式为。

化学式 | CH3COOH | H2CO3 | HA | HClO | HCOOH |
电离常数 |
0.1 mol/L的CH3COOK溶液和0.1 mol/LHCOONa溶液相比,c(K+)-c(CH3COO-)c(Na+)-c(HCOO-) (填“<”、“=”或“>”)。

请回答下列问题:
a、b、c、d四个点水电离程度由大到小的顺序为。
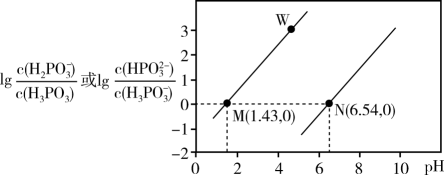
已知:常温下;
完全沉淀的
约为3.2。
请回答下列问题: