
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中先加入几滴KSCN溶液,再通入氯气 | 开始无明显现象,后溶液变红 | 溶液中一定含Fe2+ , 一定不含Fe3+ |
B | 向BaCl2 溶液中通入SO2气体 | 有白色沉淀生成 | 该白色沉淀为BaSO3 |
C | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性: S>C |
D | 在火焰上灼烧搅拌过某无色溶液的铂丝 | 火焰出现黄色 | 该溶液一定是钠盐溶液 |


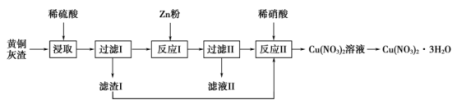

①取少量待测溶液,加入适量淀粉KI溶液,溶液变为蓝色,该反应的离子方程式为,说明FeSO4溶液已变质。
②取50.0mL待测溶液,加入足量盐酸酸化的的BaCl2溶液,得23.3 g白色沉淀,则溶液中c(SO)=。
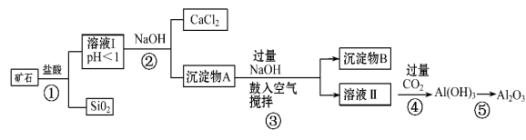

已知:加入的试剂①为溶液。
回答下列问题:

已知:不同温度KAl(SO4)2·12H2O的溶解度:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
60 |
80 |
90 |
|
KAl(SO4)2·12H2O/g |
3.00 |
3.99 |
5.90 |
8.39 |
11.7 |
24.8 |
71.0 |
109 |
回答下列问题:
Al3++HCO=Al(OH)3↓+CO2↑
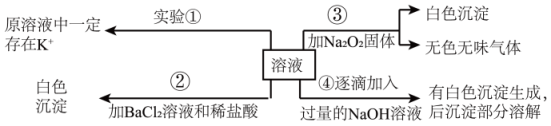
请你根据上述实验推断: