。
步骤1:将装置Ⅰ中药品A以恒定的速度滴入装有药品B的烧瓶中,确保有稳定的氨气缓慢通入装置Ⅱ;
步骤2:装置Ⅱ加热至95°C,发生反应,观察到装置Ⅱ下层液体逐渐减少,直至近乎消失时停止通入氨气。

回答下列问题:
①取少量Ⅱ中反应后的溶液于试管中,滴加溶液,振荡,出现现象,得出结论产物中含有 。
②设计实验证明产物中存在 :(简述实验操作及现象)。
 已知:①
已知:① 可加快酸性浸出的反应速率;
② 、
。
回答下列问题:
A. B.稀硫酸 C.碳酸猛(
)
Ⅰ.2H2(g)+CO(g) CH3OH(g) ΔH1=-90.8kJ∙mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ∙mol-1
Ⅲ.CO(g) +H2O(g) CO2(g)+H2(g) ΔH3=-41.3kJ∙mol-1
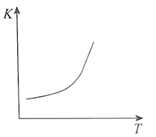

①600℃,54MPa时a点v正v逆;
②计算600℃,36MPa时该反应的平衡常数Kp=Mpa-2(Kp为用气体的平衡分压代替物质的量浓度计算的平衡常数)。

写出基态锰原子的价电子排布图:。
常作净水剂和补铁剂,SO
的立体构型是。
①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式。
②铁氰化钾中存在的化学键有(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
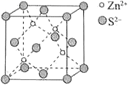
该晶胞中 的配位数为。
 已知:ⅰ.同一个碳原子上连接两个羟基是不稳定的结构,会自发脱水形成醛基或者羰基
已知:ⅰ.同一个碳原子上连接两个羟基是不稳定的结构,会自发脱水形成醛基或者羰基
ⅱ. 
R1CH=CHR2
回答下列问题
①与 溶液发生显色反应
②既能发生银镜反应又能发生水解反应
③核磁共振氢谱有四组峰且峰面积之比为6:2:1:1