传统的电解水方法需要先对水净化。近日,研究人员研发出可以直接在盐水中电解出氧气和氢气的系统,这将显著降低电解水的难度和成本。新系统用钌酸铅作正极端、用铂碳作负极端,并低温检验了电解盐水的能力,在相同功率下,该系统产生氧气量是先前系统的25倍。研究人员表示,该系统可用于火星探测,也可以在地球上电解海水,为潜艇供氧等。

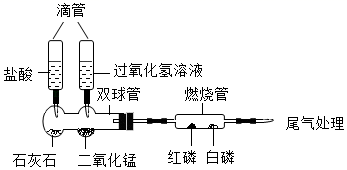
①挤压左滴管(盐酸)后加热燃烧管,白磷、红磷均未燃烧,白磷未燃烧的原因是。
②挤压右滴管(过氧化氢)溶液,双球管中反应的化学方程式为,观察到白磷燃烧,红磷未燃烧,燃烧管中有白烟产生,白烟的主要成分是(填化学式)。
③在燃烧管中仅加入镁条,挤压左滴管盐酸后并加热燃烧管,镁条燃烧,生成物是氧化镁和碳单质,该反应的基本类型是。

①MgOHCl+HCl═MgCl2+H2O ②MgCl2+H2O═MgO+2HCl
原料中增加水蒸气的目的是。
A 可循环利用的物质有NH3、MgO、CaO
B 利用MgO作为吸附剂可有效实现NH3与HCl分离
C “石灰窑”和“纯碱反应”的副产物(CO2和NH4Cl)可实现资源化利用
铝制品具有很好的抗腐蚀性能的原因是。
A 氯化钠溶液 B 稀盐酸 C 硫酸铜溶液
氧化铝在增强性能材料中发挥着重要作用。某厂用工业级硫酸铝铵[NH4Al(SO4)2•12H2O](含少量Fe、Si、Ca等杂质元素及不可溶性杂质)获得高纯氧化铝,其流程如图:
已知:NH4Al(SO4)2溶液呈酸性

上述流程中结晶的目的是。
铝碳酸镁[AlxMgy(OH)zCO3]可用于治疗胃酸过多。某兴趣小组取一定量该药片用如图装置探究其组成。
已知:Al2O3溶于氢氧化钠,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O

实验开始时,先通一定量氮气,目的是。