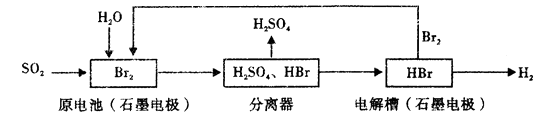



①能更好地吸收有毒气体SO2 , 防止其污染环境;
② .
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+ .
为验证Ⅱ、Ⅲ的可能性,选用如下试剂:
A.稀盐酸 B.稀硫酸 C.KSCN溶液D.KMnO4溶液 E.NaOH溶液 F.淀粉KI溶液G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的,根据溶液颜色的变化可确定假设Ⅱ是否正确.
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色,则试样中含有Fe3+ , 发生反应的离子方程式为.
步骤2.再取适量的试样滴加少量的(填试剂序号),溶液的颜色变为色,则试样中含有Fe2+ .