①Na2CO3溶液由无色变为红色,其原因是.
②NaHCO3溶液也由无色变为红色,其原因是.
③比较两份溶液的颜色,红色较浅的是(填化学式).
实验序号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
①实验1中没有出现白色浑浊的原因是.
②实验2中形成的分散系属于.
③用离子方程式表示实验2中发生的反应.


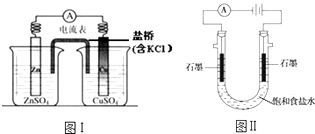
 B .
B .  C .
C . 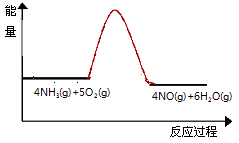 D .
D . 
NO2(g) N(g)+2O(g)
NO(g) N(g)+O(g)
O2(g) 2O(g)
①计算反应的△H=.
②请解释高温下,氨气与氧气反应难以生成NO2的原因.
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟.请用化学方程式表示白烟产生的原因.
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为.
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
①支持甲同学观点的实验证据是.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式.
实验操作 | 实验现象 |
向2mLmol/L溶液(填化学式)中通入SO2 |
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 , 用pH传感器分别测定溶液pH随时间(t)变化的曲线. |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
图1,在无氧条件下,BaCl2溶液pH下降的原因是.

已知:
ⅰ碳碳双键容易被氧化
ⅱ ![]() +Cl2
+Cl2![]()
![]()
![]()
![]()
ⅲ ![]()
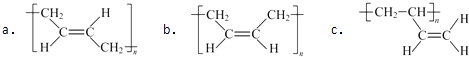
a.①的反应试剂和条件是.
b.②、③的反应类型依次是、.
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为
②有机物K与试剂x发生反应的化学方程式为.
a.含有酚羟基 b.既能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.