3SiO2(s)+6C(s)+2N2(g)═Si3N4(s)+6CO(g)

若已知CO生成速率为v(CO)=18mol•L﹣1•min﹣1 , 则N2消耗速率为v(N2)=
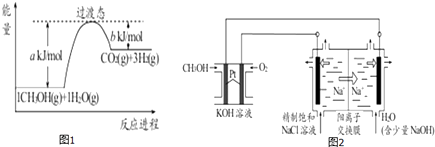
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”、“不变”).负极反应式为.
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2 . 阳极产生 ClO2的反应式为.
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为 mol.
①发生电解的总反应方程式为
②若电解后溶液的体积还是200mL,溶液的pH=
③电解后加入下列固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4 .
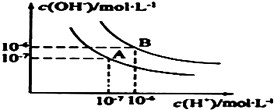
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
根据上述实验现象,回答下列问题: