|
|
| a |
| b | c |
d |
| e |
|
|
| f |
①按照物质类别对上述反应中的各物质进行分类,未涉及的物质类别是(填序号)。
A.金属氧化物 B.非金属氧化物 C.酸 D.盐
②发生还原反应的产物是(写化学式);该反应(填“能”或“不能”)用稀硫酸代替盐酸。
操作 | 现象 | 结论或离子方程式 |
步骤1:取少量滤液a进行①(填实验名称)。 | 火焰呈②。 | 滤液a中含有 |
步骤2:另取少量滤液a于试管中,依次滴入③(填化学式)溶液和氯水。 | 溶液先无红色,后变红色。 | 滤液a中含有 |
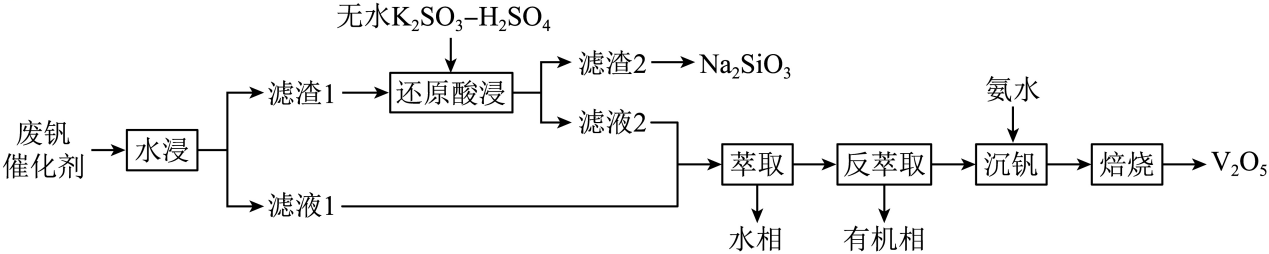
已知:钒的氧化物在酸性条件下以、
存在,
增大时
可转化为
沉淀。
①硫酸的用量会影响钒的浸出率,需保持在1.2以下的原因是。
②过程中除了有被还原成
, 还涉及的反应离子方程式为。
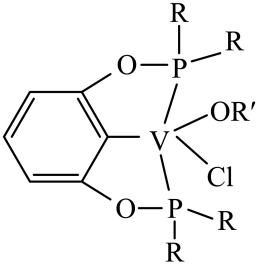
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供(选填“孤对电子”或“空轨道”)。