
已知:①甲醇沸点61.7℃。
②六水合三氯化铬易溶于水、可溶于乙醇、不溶于乙醚。
③的性质与
类似。

回答下列问题:
第1次 | 第2次 | 第3次 |
20.05mL | 20.30mL | 19.95mL |
①“继续加热煮沸一段时间”的目的是。
②滴定终点的现象为。
③该产品的纯度为%(结果保留1位小数)。
化学键 | ||||
键能/( | 348 | 615 | 413 | 436 |


①表示的曲线为(填“M”或“N”)。
②a点反应的平衡常数kPa(列出计算式,分压=总压×物质的量分数)。

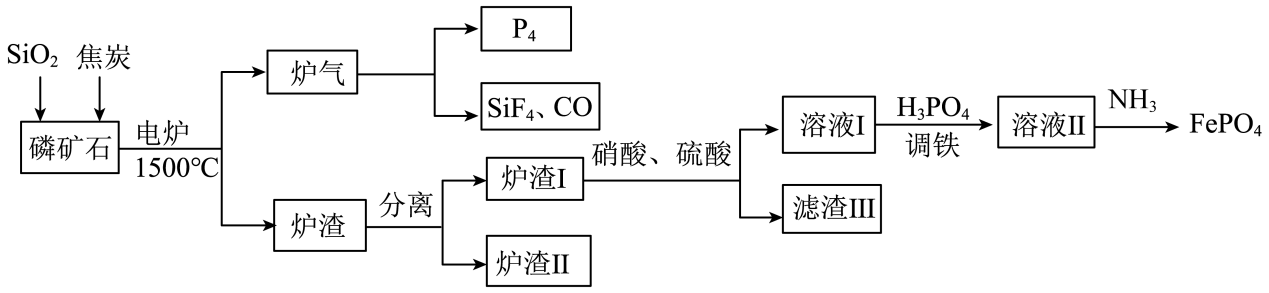
已知:①FePO4可溶于pH<2的酸性溶液。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
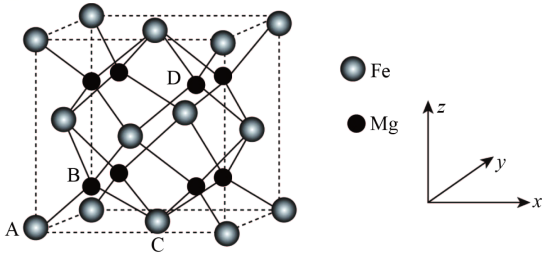
其中A的原子坐标参数为(0,0,0), B为( ,
,
),C为(
,
, 0),则D点的坐标参数为。此晶胞中Fe的配位数是。
 B . O3分子的球棍模型:
B . O3分子的球棍模型: D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3