已知:25℃时,的电离常数:
,
;
的电离常数:
,
;
的溶度积常数:
。
Ⅰ.性质探究
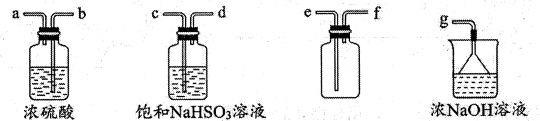
①甲同学认为发生了相互促进的水解反应,生成了胶体,用激光笔照射试管,预期的现象为。
②若上述水解过程存在反应: , 则25℃时该反应的化学平衡常数K=(代入数据列出计算式)。
③乙同学认为可能同时发生反应: , 并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加溶液,观察现象。
A.KSCN B. C.
D.
已知所得产物含有少量(无其他杂质),25℃时相同质量的
和
分别溶于等量的水后,体积基本相同。
①25℃时质量分数相同的两种溶液,溶液的pH
溶液。
A.大于 B.小于 C.等于 D.无法判断
②丙同学设计实验探究实验产品是否符合化工行业标准。
查阅资料 合格品的行业标准是质量分数高于93%。
提出假设 实验产品中质量分数高于93%。
实验方案 常温下完成下述实验:
步骤1:用100.0mL水溶解0.7g和9.3g
, 测得
;
步骤2:,测得;
数据分析:ab(填“>”、“<”或“=”)。
实验结论 假设成立。
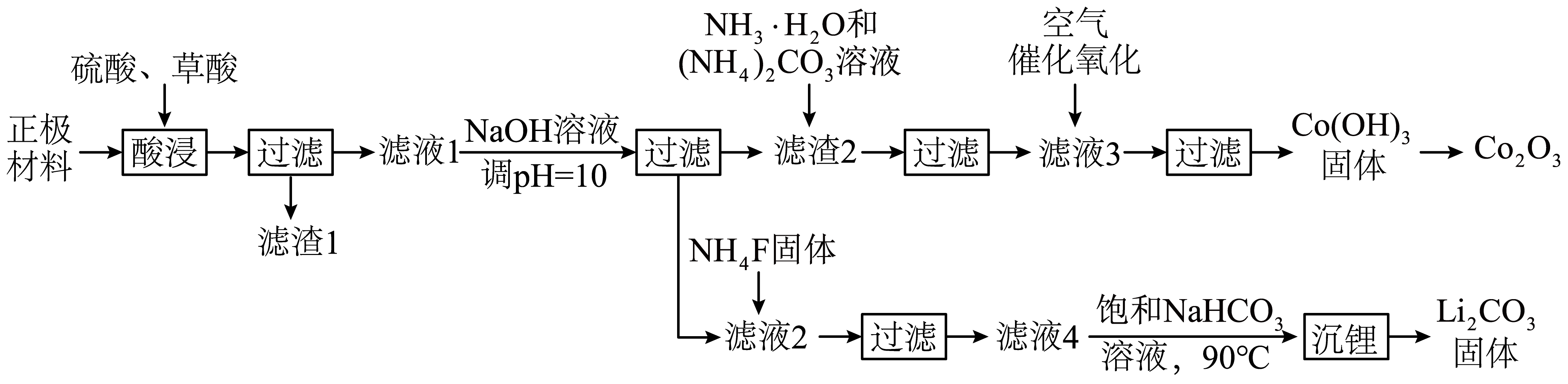
固体已知:①常温时,有关物质如下表:
物质 | ||||
②常温时,的溶度积
, 该数值随温度升高而减小。
①补充完整上述离子方程式;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是。
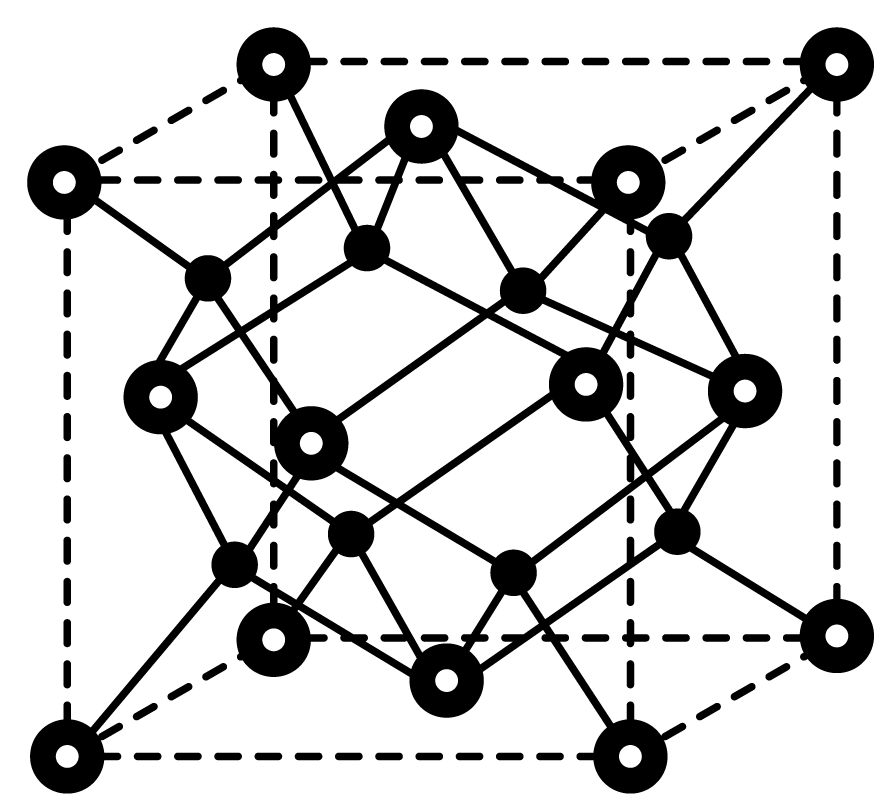
①在晶胞中的位置为;
②设阿伏加德罗常数的值为。晶胞
的密度为b
, 则晶胞参数(棱长)为pm。

②催化加氢制低碳烯烃,反应历程如下图所示,
首先在
表面解离成2个
, 随后参与到
的转化过程。

注:“□”表示氧原子空位,“*”表示吸附在催化剂上的微粒。
理论上反应历程中消耗的与生成的甲醇的物质的量之比为。

①(填“>”“<”或“=”)。
②下列说法正确的有。
A.b点时达到平衡状态
B.a点时容器内气体密度大于b点
C.平均相对分子质量不再改变时,该反应达到平衡状态
D.温度高于后
转化率下降,原因可能是该反应

序号 | 反应的官能团 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
a |
| |||
b | 氧化反应(生成有机物) |
 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:①最后一步反应中,环状有机反应物为(写结构简式)。
②相关步骤涉及到醇的氧化反应,该反应的化学方程式为。
③从![]() 出发,第一步的化学方程式为(注明反应条件)。
出发,第一步的化学方程式为(注明反应条件)。