
I.制备产品,步骤如下:
①称取2.0gNH4Cl固体,用5mL水溶解,加到锥形瓶中。
②分批加入3.0 g CoCl2·6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL6%的双氧水。
③加热至55-60℃反应20min,冷却,过滤。
④将滤得的黑黄固体转入含有少量盐酸的25mL沸水中,趁热过滤。
⑤滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
①称取ag产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1mLc1mol·L-1AgNO3溶液,并加3mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2mL溶液。(已知: ,
)
回答下列问题:
产品的质量分数为。(列出计算式)
①已知室温下难溶物溶度积常数如下表,离子浓度小于10-5mol/L,认为沉淀完全。
难溶物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | FePO4 |
KSD |
② ,
,
回答下列问题:
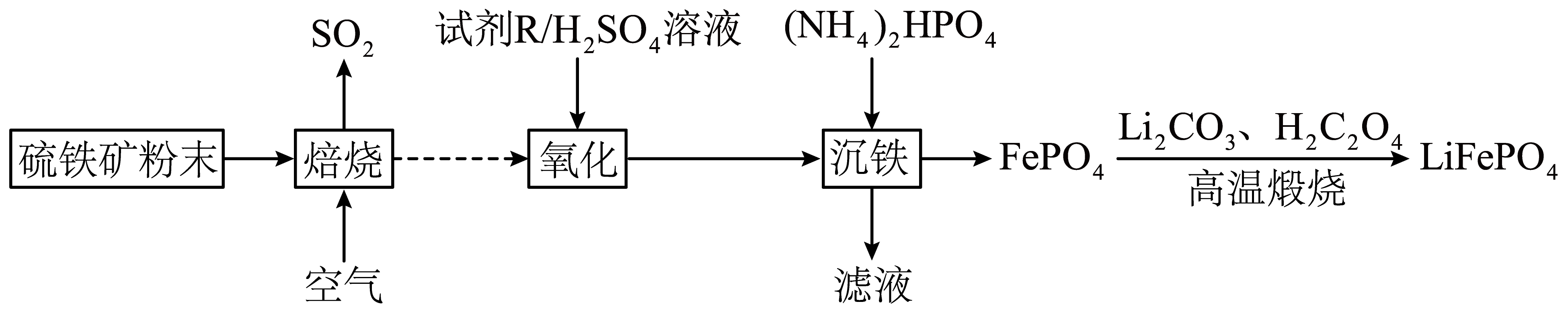
①若“酸浸”工序用硫酸,“还原”工序加入FeS。“还原”工序的离子方程式为,滤渣的成分是(填化学式)。
②“除铝”工序可加入的难溶物质是(填化学式),除净铝离子需要调节的最小pH为(结果保留一位小数)。
A.HNO3 B.H2O2 C.Ca(ClO)2 D.KMnO4
判断是否氧化彻底的试剂名称为。

主反应①:△H1<0
副反应②:△H2<0
副反应③:△H3>0
某温度下反应均达平衡后,测得CH3OH为1mol、CH4为0.4mol、CO为0.2mol, 则CH3OH的选择性为()。反应②的平衡常数(只列出计算式)。

通过图示分析,更适合生产甲醇的温度为(填标号),
A.400℃ B.600℃ C.800℃ D.1000℃
高于800℃时,CO2转化率增大的主要原因是。

已知参与化学键变化的元素替换成更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化曲线为(填c、d),写出MO+与CHD3反应生成的氘代甲醇的结构简式。

已知:
①

②→

③苯环上的卤原子较难水解。
回答下列问题:
①含有苯基和氨基,且二者直接相连,但Br原子不与苯环直接相连;
②属于酯类,可发生银镜反应;
③含有手性碳原子。
 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)